
Morino-Koga S.*, M. Tsuruda, X. Zhao, S. Oshiro, T. Yokomizo, M. Yamane, S. Tanigawa, K. Miike, S. Usuki, K. Yasunaga, R. Nishinakamura, T. Suda, M. Ogawa*. Transition of signal requirement in hematopoietic stem cell development from hemogenic endothelial cells. Proc Natl Acad Sci USA, 2024 (in press).
(* Co-corresponding authors)
掲載誌:PNAS. In press.
DOI:10.1073/pnas.2404193121
URL:https://www.pnas.org/doi/10.1073/pnas.2404193121
ポイント
概要説明
熊本大学発生医学研究所 組織幹細胞分野の古賀沙緒里助教及び小川峰太郎教授のグループは、造血幹細胞の前駆細胞である血管内皮細胞から造血幹細胞を試験管内で分化誘導することに成功しました。これまで、血管内皮細胞から造血幹細胞を試験管内で分化させるためには、遺伝子改変した支持細胞との共培養や血清存在下での培養が必要でした。そのため、汎用性が低く、血清中のサイトカイン等の影響があるためメカニズム解明の妨げになるという問題点がありました。そこで本研究では、誰でも利用できる材料のみを使用した血清フリーの培養法の構築を目指しました。
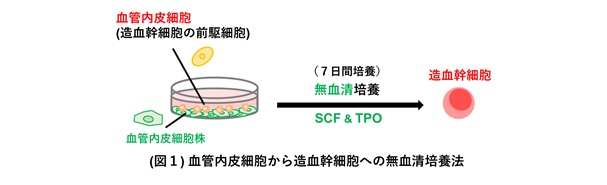
造血幹細胞の発生は、胎生期に大動脈の血管内皮細胞から始まります。血管内皮細胞からプレ造血幹細胞が発生し、このプレ造血幹細胞が造血幹細胞へと分化します。はじめに、マウス胚体内のプレ造血幹細胞が発現しているシグナル因子受容体を探索した結果、SCF (ステムセルファクター) の受容体であるKITと、TPO (トロンボポエチン) の受容体であるMPLを発現していることが分かりました。そこで、マウス胚体から単離したプレ造血幹細胞を無血清培養液で培養する際に、SCFとTPOを添加したところ、どちらか一方だけでは造血幹細胞には分化しませんでしたが、両方が添加された条件で造血幹細胞に分化しました。さらに、血管内皮細胞からプレ造血幹細胞を経て造血幹細胞に分化させるためには、SCFとTPOに加えて、血管内皮細胞株を支持細胞として加える必要があることも分かりました。この培養には、市販されている一般的な血管内皮細胞株と、サイトカインとしてSCFとTPOのみを用いており、汎用性の高い培養法の構築に成功しました (図1)。
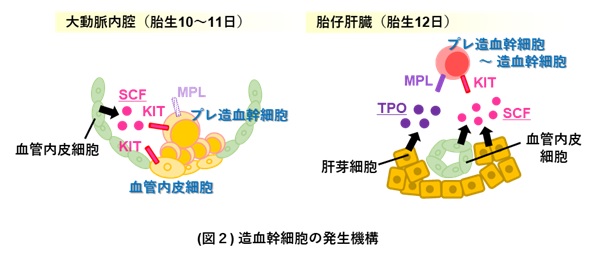
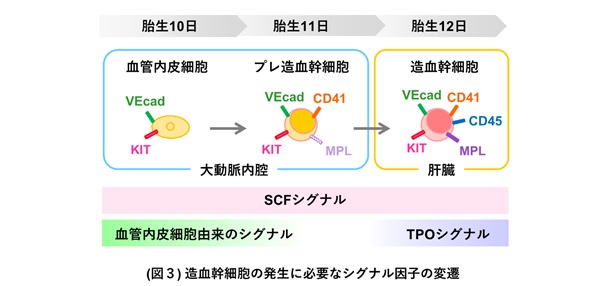
胚体内において、血管内皮細胞からプレ造血幹細胞が発生する場所は大動脈の内腔です。この環境には血管内皮とそれが産生するSCFが存在しますが、TPOは存在しませんでした。TPOは肝臓の肝芽細胞だけが産生するため、プレ造血幹細胞は大動脈内腔から肝臓へと移行した後、TPOのシグナルを受け取って造血幹細胞へ分化することが分かりました (図2)。これらの結果から、血管内皮細胞からプレ造血幹細胞への分化には血管内皮とSCFが存在する大動脈内腔の環境が必要であり、プレ造血幹細胞から造血幹細胞への分化にはSCFとTPOが存在する肝臓の環境が必要であることが明らかになりました (図3)。本研究により構築した培養法は、血管内皮細胞から造血幹細胞が発生する過程に必要な環境を備えており、胚体内における造血幹細胞の発生を再現していると考えられます。
本研究成果は、日本時間2024年7月23日に米国科学アカデミー紀要『Proceedings of the National Academy of Sciences of the United States of America (PNAS)』のオンライン版に掲載されました。また、本研究は文部科学省 科学研究費助成事業、公益財団法人 稲盛財団、熊本大学 めばえ研究推進事業、熊本大学 発生医学研究所 共同研究拠点、熊本大学 発生医学研究所 高深度オミクス医学研究拠点ネットワーク形成事業の支援を受けて実施されました。
用語解説
*1: 造血幹細胞
骨髄に存在し、自分自身を複製する能力(自己複製能)と全ての血液細胞に分化できる能力(多分化能)を併せ持つ組織幹細胞の一つ。胎児期に発生し、生後から生涯にわたって血液細胞を産生し続ける。
*2: 血管内皮細胞
血管の最も内側の層(血管内皮)を形成し、血管内腔面を裏打ちしている細胞。一部の血管内皮細胞は胎児期に一過性ではあるが血液細胞へと転換する能力を持ち、造血幹細胞の起源となるプレ造血幹細胞を生み出す。