
Shunsuke Tanigawa, Etsuko Tanaka, Koichiro Miike, Tomoko Ohmori, Daisuke Inoue, Chen-Leng Cai, Atsuhiro Taguchi, Akio Kobayashi, Ryuichi Nishinakamura. Generation of the organotypic kidney structure by integrating pluripotent stem cell-derived renal stroma. Nature Communications 13:611, 2022.
doi.org/10.1038/s41467-022-28226-7
[概要説明]
腎臓は、多数に分岐する管の周囲に濾過を司る装置が配置された複雑で高次な構造を持つ臓器です。この「高次構造」は、「ネフロン前駆細胞」、「尿管芽」、「間質前駆細胞」という3種類の前駆細胞から作られます。熊本大学発生医学研究所の腎臓発生分野(西中村隆一教授)はこれまでに、この3つのうち2つの前駆細胞(ネフロン前駆細胞と尿管芽)を多能性幹細胞(マウスES細胞やヒトiPS細胞)から人為的に誘導する方法を確立してきました。今回、同グループの谷川俊祐講師、田中悦子大学院生らは、マウスES細胞から間質前駆細胞を誘導する方法を開発しました。さらに誘導した間質前駆細胞を、同じくマウスES細胞から誘導したネフロン前駆細胞と尿管芽と組み合わせることで、完全にマウスES細胞由来の腎臓の高次構造を人工的に再構成することに成功しました。人工的に作った腎臓組織をマウスに移植すると血管が進入し、成熟がさらに進みました。
本研究は、腎臓という複雑臓器特有の高次構造を試験管内で完全に多能性幹細胞のみから構築することに成功した初めての報告です。この技術をヒトの多能性幹細胞 (iPS細胞) に応用すれば、移植用の臓器を作るという次世代の再生医療に向け大きな前進となります。また、腎臓疾患の病態解明と創薬開発に繋がることも期待されます。
本研究成果は、科学雑誌「Nature Communications」のオンライン版に2月1日に掲載されました。本研究は、文部科学省科学研究費補助金(基盤研究(S))の支援を受けました。
[背景]
腎臓は尿を生成することで生命維持に重要な役割を持っていますが、再生しない臓器です。腎不全による人工透析患者数は国内で33万人を超えていますが、腎移植の機会は限られています。腎臓を人工的に作ろうとする際に問題となるのは、腎臓が、多数に分岐する管の周囲に濾過を司る装置が配置された複雑で高次な構造を持つ臓器であることです。この「高次構造」はネフロン前駆細胞、尿管芽及び間質前駆細胞の3つの前駆細胞から作り上げられます(図)。ネフロン前駆細胞は血液を濾過して尿を産生する重要な装置であるネフロン(糸球体や尿細管)に分化します。一方、尿管芽は多数に分岐して集合管と呼ばれる尿の排泄路を作り、その分岐の先端で各々のネフロンと繋がります。これらネフロンや集合管の隙間を埋めるのが間質であり、3番目の間質前駆細胞から作られます。しかしこの間質前駆細胞は、ネフロンの分化や尿管芽の分岐をコントールする役割も持つため、これがないと腎臓の高次構造は形成されません。
熊本大学発生医学研究所腎臓発生分野は2014年に、マウスES細胞及びヒトiPS細胞からネフロン前駆細胞の誘導法を確立して、ネフロンを含む腎臓組織の作製に世界に先駆けて成功しました (Cell Stem Cell)。さらに2017年には、尿管芽を多能性幹細胞から誘導する方法を発表しています (Cell Stem Cell)(図)。今回は、間質前駆細胞を多能性幹細胞から誘導する方法を確立し、ネフロン前駆細胞及び尿管芽と組み合わせることで、多能性幹細胞から高次構造を有する腎臓を作ることを目的としました。
[研究の内容]
まず胎児期のマウス腎臓を用いて、間質前駆細胞に特徴的な遺伝子群やその発生メカニズムを同定しました。次に、間質前駆細胞の起源である後方中間中胚葉と呼ばれる組織を抗体を用いて単離する方法と、それを間質前駆細胞まで誘導する培養条件を確立しました。これらを基に、マウスES細胞から後方中間中胚葉を経由して間質前駆細胞を誘導する方法を開発しました(図)。この誘導した間質前駆細胞を、同じくES細胞から誘導したネフロン前駆細胞及び尿管芽と組み合わせて試験管内で培養することで、多数に分岐する集合管の周囲にネフロンが配置された腎臓本来の高次構造を作ることに成功しました(図)。この腎臓組織をマウスに移植すると、血管が進入してさらに成熟し、濾過機能に重要なメサンギウム細胞や血圧調節を担うレニン産生細胞など特殊な間質細胞もES細胞から分化しました。つまり、腎臓形成に必須な3つのピースのうち欠けていた3つ目(間質前駆細胞)の誘導法を確立することで、完全に多能性幹細胞由来の高次構造を持つ腎臓を構築することに成功しました。
[成果]
本研究は、間質前駆細胞の誘導法を確立し、他の2種類の前駆細胞と組み合わせることで、完全に多能性幹細胞由来の腎臓の高次構造構築を実現したものです。腎臓という複雑な臓器本来の高次構造を試験管内で多能性幹細胞から構築することに成功した初めての報告であり、ヒトあるいは他臓器への応用が期待されます。
[展開]
ネフロン前駆細胞と尿管芽をヒトiPS細胞から誘導する方法は既に同グループから発表済みです。間質前駆細胞の誘導法をヒトのiPS細胞に適用すれば、高次構造を持つヒト腎臓を作れるようになるはずであり、将来の移植可能な腎臓作製に向けた重要な技術基盤になります。また、より本物に近い腎臓を作ることで、病態の再現や創薬への貢献も期待されます。
分岐する管構造の周囲に機能ユニットが配置されるという高次構造は腎臓に限ったものではなく、肺や肝臓、膵臓など多くの臓器に共通しています。今回用いた間質前駆細胞誘導法の原理を応用すれば、他臓器でも同様の高次構造を試験管内で作れるようになる可能性があります。
[用語解説]
・ES細胞:受精卵から作られた多能性幹細胞。胚性幹細胞。
・iPS細胞:皮膚や血液などの体細胞から作られた多能性幹細胞。
・多能性幹細胞:ES細胞やiPS細胞など。様々な体細胞に分化し得る万能細胞。
・ネフロン:腎臓の最小機能単位であり、糸球体や尿細管で構成される。ヒトの腎臓には約100万個存在する。
・糸球体:腎臓内で血液から尿をろ過する部位。
・集合管:糸球体で濾過された尿を集めて流す管。多数に分岐している。
・間質:ネフロンや集合管の周囲を埋める細胞群。これらの起源である間質前駆細胞からは、濾過機能に重要なメサンギウム細胞や血圧調節を担うレニン産生細胞も作られる。
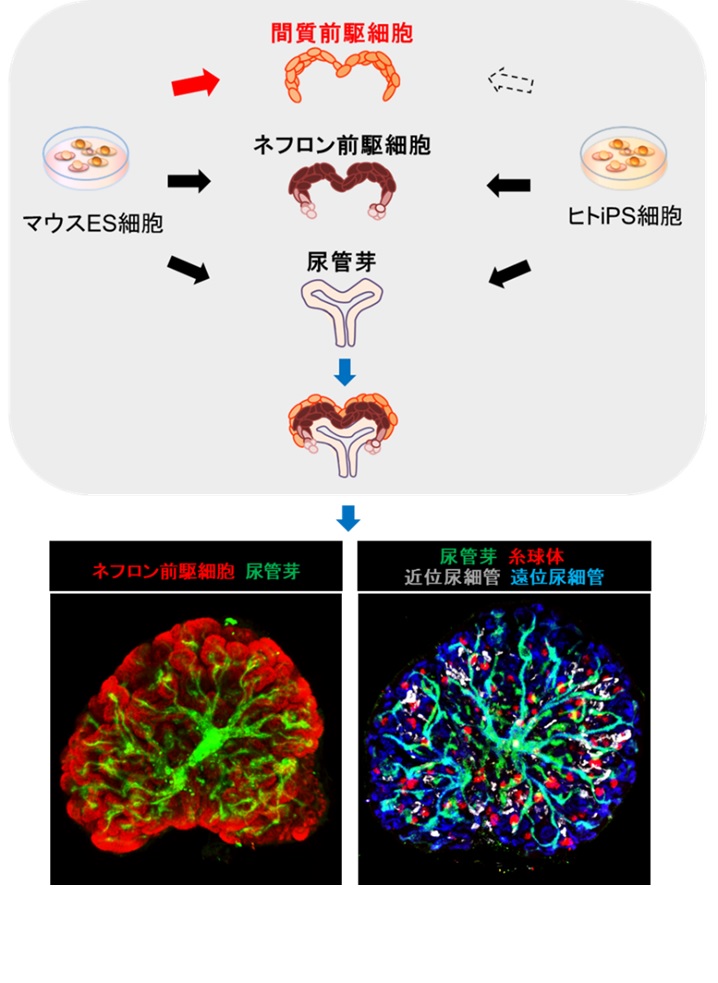
[図の説明]
マウスES細胞から間質前駆細胞の誘導法を開発し(赤矢印)、同じくES細胞から誘導したネフロン前駆細胞及び尿管芽(黒矢印)と組み合わせることで、分岐する集合管の周囲にネフロン前駆細胞やネフロン(糸球体や尿細管)が配置された高次構造を持つ腎臓組織を作製した(青矢印)。ヒトiPS細胞からネフロン前駆細胞と尿管芽を誘導する方法は報告済みであり、間質前駆細胞誘導法の開発が待たれる(点線の矢印)。