タイトル:The endothelial Dll4−muscular Notch2 axis regulates skeletal muscle mass.
著者:Fujimaki S, Matsumoto T, Muramatsu M, Nagahisa H, Horii N, Seko D, Masuda S, Wang X, Asakura Y, Takahashi Y, Miyamoto Y, Usuki S, Yasunaga KI, Kamei Y, Nishinakamura R, Minami T, Fukuda T, Asakura A, Ono Y.
雑誌:Nature Metabolism. 2022 Feb;4(2):180-189.
【ポイント】
✔不活動(運動不足,低活動,活動量低下)や糖尿病の状態では,血管からDll4が放出され,筋線維のNotch2受容体※2を活性化させることで筋量の減少(筋萎縮)が誘導されるメカニズムを発見しました。
✔この「Dll4-Notch2軸」の働きを抑えると,不活動や糖尿病による筋萎縮を顕著に改善できること,さらに,過負荷による筋量の増大(筋肥大)を促進できることを見出しました。
✔本研究成果は,加齢や慢性疾患にともなうサルコペニアやフレイルに対する予防治療法の開発に貢献します。
【概要説明】
我が国をはじめ世界的に急速な高齢化が進行しており,それにともない増加するサルコペニアやフレイルが社会問題となっています。この問題を解決し健康長寿社会を実現するためには,筋萎縮を抑え生涯にわたって筋量を維持することが重要です。しかし筋萎縮を引き起こす上流のメカニズムについてはよくわかっていませんでした。
今回,筋発生再生分野(小野悠介独立准教授)の藤巻慎助教らは,個々の筋線維をくまなく取り囲む毛細血管は酸素や栄養を運搬する役割に加え,筋萎縮を引き起こすカギを握っていることを発見しました。具体的な仕組みは,不活動(運動不足,活動量低下)あるいは糖尿病などの状態下では,毛細血管から可溶型Dll4が放出され,それが筋線維のNotch2受容体を活性化することで筋萎縮が誘導されるというものです。マウスを用いて「Dll4-Notch2軸」の働きを減弱させると,不活動や糖尿病による筋萎縮を抑制できることに加え,筋力トレーニングを模倣した過負荷モデルによる筋肥大を促進することがわかりました。「Dll4-Notch2軸」は筋萎縮を誘導するための重要な上流メカニズムとなり,加齢や慢性疾患にともなうサルコペニアやフレイルに対する有望な予防治療標的になると考えられます。
タイトル:Hoxa10 mediates positional memory to govern stem cell function in adult skeletal muscle
著者:Yoshioka K, Nagahisa H, Miura F, Araki H, Kamei Y, Kitajima Y, Seko D, Nogami J, Tsuchiya Y, Okazaki N, Yonekura A, Ohba S, Sumita Y, Chiba K, Ito K, Asahina I, Ogawa Y, Ito T, Ohkawa Y, Ono Y.
雑誌:Science Advances. 2021 Jun 9. 7: eabd7924.
【ポイント】
✔筋肉とその再生を担う筋幹細胞は,身体の位置による固有の情報(位置記憶)をもつことを発見しました。
✔位置記憶は,胎児期に手足などのからだの形作りに働くHox遺伝子群の発現パターンに基づくます。
✔本研究成果から,筋ジストロフィーなどの筋疾患の病態解明の手掛かりを得るとともに,位置記憶を応用した再生医療の開発に役立つことが期待できます。
【概要説明】
熊本大学発生医学研究所の吉岡潔志研究員,小野悠介准教授の研究グループは,長崎大学,九州大学,京都府立大学との共同研究により,全身に隈なく分布する成体の骨格筋(筋肉)およびその再生を担う筋幹細胞は,身体位置固有の情報(位置記憶)を保持していることを発見しました。この位置記憶は胎児期から維持されており,胚発生過程にからだの設計を司るホメオボックス(Hox)遺伝子群の発現とその遺伝子座のDNAメチル化パターンにより可視化することができました。また,マウスの後肢の筋幹細胞を頭部筋に移植すると,後肢のHox遺伝子を維持した状態で頭部筋が再生されることから,強力に固定された位置記憶は移植再生治療に影響を与える可能性が示唆されました。
さらに,筋幹細胞特異的にHoxa10遺伝子を欠損させたマウスでは後肢における筋再生不全が見られ,発現位置に依存した筋再生不全の表現型を呈することがわかりました。このメカニズムの解析を行い,Hoxa10遺伝子は後肢における筋幹細胞の正常な細胞分裂に欠かせない機能を持っていることを突き止めました。また,マウスと同様,ヒトにおいても筋幹細胞の位置記憶は保存されていることを確認し,本研究結果から,筋幹細胞の位置記憶は単なる胎児発生の残存ではなく,身体位置固有の機能を担っていることが明らかになりました。
筋ジストロフィーはいくつかの病型があり,脆弱化する筋肉の身体位置は病型によってそれぞれ異なります。また,加齢による筋肉の脆弱化も身体位置の特異性があります。しかし,一見同じようにみえる筋肉になぜ位置特異的な症状が出るのかは全く分かっていません。今後本研究グループは,位置記憶の機能的な側面から筋疾患のメカニズム解明に取り組むとともに,位置記憶を応用した新たな筋再生治療の開発を進めていきます。
(令和2年9月2日)
タイトル:The body-region-specificity in murine models of muscle regeneration and atrophy.
著者:Yoshioka K, Kitajima Y, Seko D, Tsuchiya Y, Ono Y.
雑誌:Acta Physiologica (Oxf). 2021 Jan;231(1):e13553.
【概要説明】
全身に分布する骨格筋は,その大きさや形状は解剖学的に多様であり,またその機能も身体動作のみならず,呼吸,咀嚼,嚥下,表情表出等と多岐にわたります。骨格筋は代謝や収縮特性から速筋と遅筋に分類されます。近年,このような速筋・遅筋の分類に加え,身体部位によって筋質に違いがあることが報告されています。しかし,筋損傷や筋萎縮刺激に対する部位特異的応答性についてはあまりわかっていませんでした。今回,さまざまな病態モデルマウスを用いて,骨格筋の損傷—再生や萎縮の部位特異性について包括的に調べました。
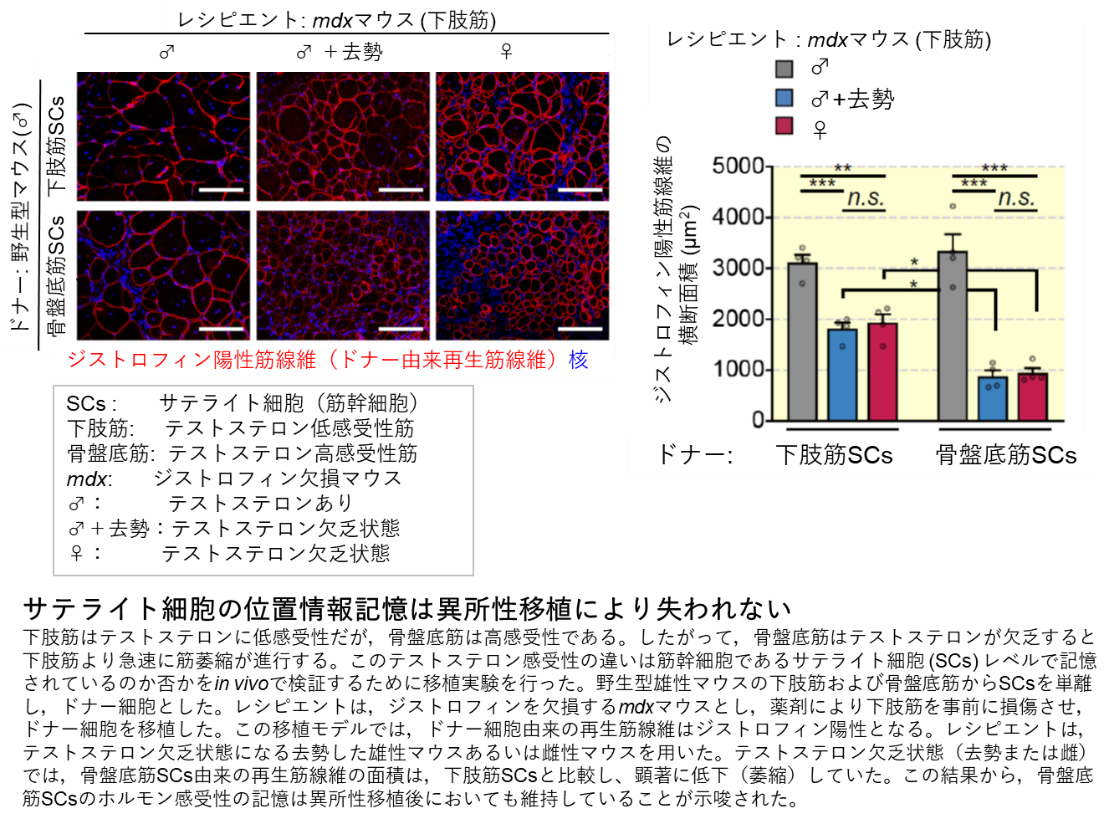
本研究では,BaCl2筋注による一過性筋損傷—再生モデル,慢性的に筋損傷-再生が生じる筋ジストロフィーモデル (mdxマウス),がん細胞株移植によるがんカヘキシアモデル,加齢による老化モデル,去勢による男性ホルモン(テストステロン)欠乏モデルを用いて,身体部位による筋再生能や筋萎縮感受性の違いを評価しました。その結果,一過性の筋損傷—再生モデルでは,損傷後,頭部筋の筋重量は徐々に回復し,10ヵ月後には元に戻る一方,下肢筋は損傷から2週間で筋重量は元に戻り,その後は過成長を示しました。このような再生パターンは慢性的損傷—再生モデルのmdxマウスでも同様に観察されたことから,筋損傷からの再生様式は身体部位特異的であることがわかりました。続いて,筋萎縮モデルを解析しました。がんカヘキシアマウスおよび老齢マウスは,ともに上肢・下肢筋に萎縮を認めますが,頭部筋は萎縮抵抗性を示しました。一方,去勢によるテストステロン欠乏マウスは,頭部筋および上肢・下肢筋は影響を受けませんが,骨盤底筋は著しい筋萎縮を引き起こしました。次に,骨格筋の成長や再生に必須である骨格筋幹細胞(サテライト細胞)に着目し,身体部位による筋萎縮感受性の違いはサテライト細胞に記憶されているのか否かを調べました。テストステロン感受性が高い骨盤底筋からサテライト細胞を単離し,下肢への異所性移植を行いました。その結果,ドナーの骨盤底筋由来サテライト細胞は,レシピエントの下肢筋に生着後,多数の筋線維を生み出しますが,テストステロンへの感受性は失うことなく,高く維持されていました。また,骨盤底筋の特異的遺伝子発現パターンは,レシピエントの下肢筋内で維持されていました。したがって,ドナーのサテライト細胞は異所性移植後もレシピエントの筋内で「位置情報の記憶(ポジショナルメモリー)」を保持していると考えられます。
本成果から,骨格筋の再生や萎縮の部位特異性が明らかとなり,そのメカニズムの1つとして組織幹細胞レベルのポジショナルメモリーが関与する可能性が示唆されました。ポジショナルメモリーは効果的な筋再生治療法の開発に欠かせない視点であり,今後,その分子基盤の解明に取り組みます。
タイトル:Damaged myofiber-derived metabolic enzymes act as activators of muscle satellite cells.
著者:Tsuchiya Y, Kitajima Y, Masumoto H, Ono Y.
雑誌:Stem Cell Reports. 2020 Oct 13;15(4):926-940.
【ポイント】
✔肉離れ等で損傷した筋肉を再生するためには,筋幹細胞の活性化,増殖,筋分化という3つのステップが必要です。しかし,最初のステップである筋幹細胞の活性化のメカニズムについては,ほとんどわかっていませんでした。
✔本研究グループは,損傷した筋肉から漏出する成分が筋幹細胞を活性化させるといった,極めて合理的な組織再生の仕組みがあることを発見しました。
✔本研究では,損傷した筋肉から漏出する成分を「損傷筋線維由来因子(DMDFs)」と命名しました。今後,さまざまなDMDFsの多様な機能を解明することで,筋疾患の病態解明や創薬開発への展開が期待されます。
【概要説明】
私たちは激しい運動等で筋肉が損傷しても再生する力を備えています。この再生には筋線維の周囲に存在するサテライト細胞*と呼ばれる筋幹細胞が欠かせません。サテライト細胞は通常眠った状態(休止期)で存在していますが,筋がダメージを受けて損傷すると速やかに,目覚め(活性化),増殖を繰り返し,筋分化することで,損傷した筋線維を再生します。つまり,筋線維が損傷して再生するまでには,サテライト細胞の活性化,増殖,筋分化という3つのステップが必要になります。しかし,最初のステップである活性化はどのように起こるのか,そのメカニズムについてはよくわかっていませんでした。
今回,熊本大学 発生医学研究所 筋発生再生分野の土屋吉史 研究員(日本学術振興会PD特別研究員)は,小野悠介 准教授,長崎大学の増本博司 講師とともに,培養系での筋損傷モデルを構築し,損傷した筋線維から漏出する成分がサテライト細胞を活性化させることを見出しました。本研究グループはこのような漏出成分を「損傷筋線維由来因子(DMDFs:Damaged myofiber-derived factors)」と命名し,DMDFsの質量分析解析を行い,サテライト細胞を活性化させるタンパク質の同定を試みました。その結果,DMDFsとして同定された代謝酵素は,休止期のサテライト細胞を速やかに活性化させ,筋損傷からの再生を加速させる働きがあることを見出しました。本研究から,損傷した筋肉そのものがサテライト細胞を活性化させるといった,極めて合理的で効率的な再生メカニズムが存在することが明らかになりました。DMDFsは多種多様な機能があると予想されるため,今後,DMDFsのさらなる機能解明を進め,筋疾患の病態解明や創薬開発へ展開していきます。
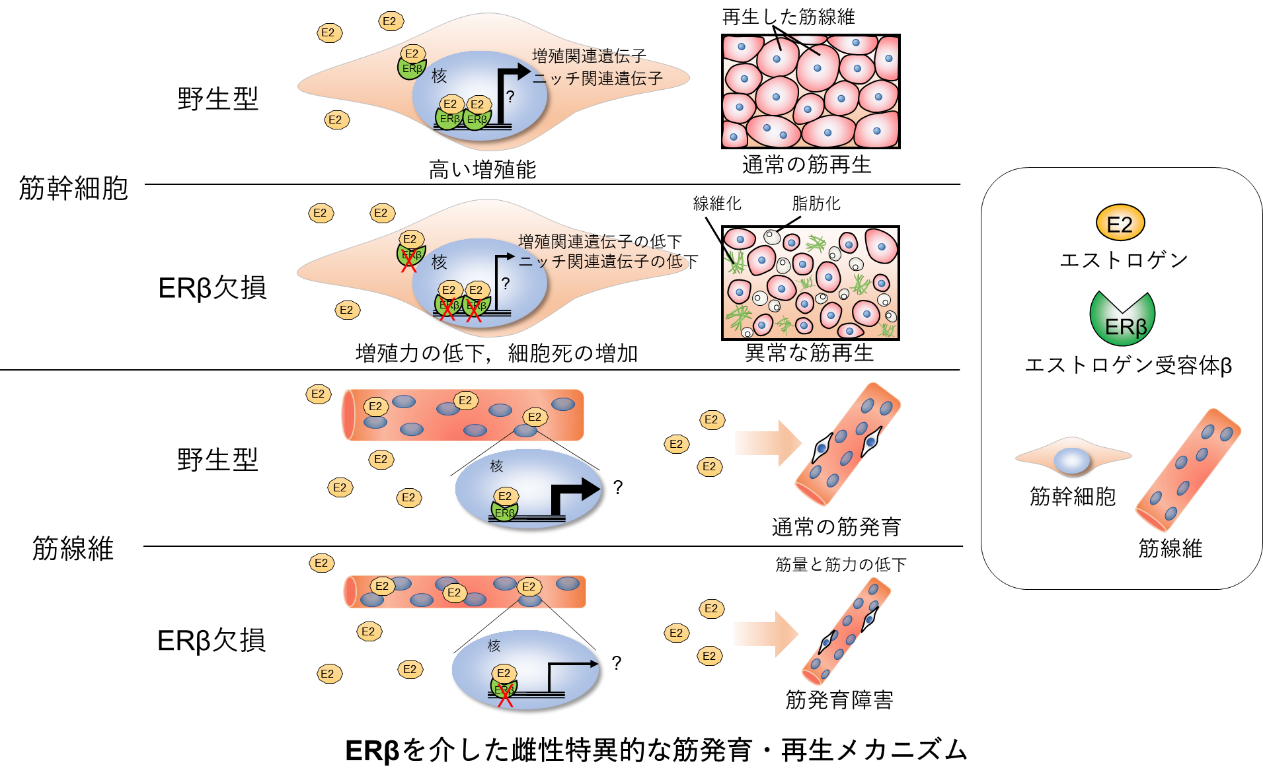
タイトル: Estrogen receptor β controls muscle growth and regeneration in young female mice
著者:Seko D, Fujita R, Kitajima Y, Nakamura K, Imai Y, Ono Y.
雑誌:Stem Cell Reports 2020 Sep 8;15:577–586.
【ポイント】
✔本研究グループは,これまでに女性ホルモンであるエストロゲンが骨格筋の発育・発達や再生に重要であることを明らかにしてきましたが,その作用機序は不明でした。
✔今回,その作用機序として,筋線維や筋幹細胞に発現するエストロゲン受容体β(ERβ)を同定しました。
✔今後,ERβやその下流シグナルを標的にすることで,サルコペニアなどの筋脆弱症の病態解明と予防治療への応用を目指します。
【概要説明】
私たちの筋肉(骨格筋)は生後,発育・発達し,成人になると運動習慣等によってその大きさや質が変化します。また,骨格筋は激しい運動や打撲等により損傷しますが,内在する筋幹細胞の働きにより再生することができます。骨格筋を生涯にわたって健常に維持することは健康寿命延伸のカギを握ることから,骨格筋に関する研究は近年,急速に進んでいます。しかし,これまでのほとんどの基礎研究は雄性動物を対象にしたものであり,性差についてはあまり考慮されていませんでした。女性ホルモンであるエストロゲンは,さまざまな組織の恒常性維持に重要な役割を担っています。近年の疫学調査により,血中エストロゲンレベルの減少と筋力低下の関連が指摘されていますが,その作用機序については,よくわかっていません。
今回,熊本大学 発生医学研究所 筋発生再生分野の瀬古大暉 特別研究学生(長崎大学大学院生)は,小野悠介准教授、筑波大学の藤田諒助教,長崎大学の北島百合子講師,愛媛大学の今井祐記教授とともに,エストロゲンの受容体の1つであるエストロゲン受容体β(ERβ)に着目し,筋線維特異的または筋幹細胞特異的ERβ遺伝子欠損マウスを作出し,解析しました。その結果,ERβの機能が阻害された雌性マウスは,骨格筋の発育・再生に異常が観察されました。この異常は雄性マウスではみられないことから,エストロゲンとその下流シグナルは女性特有の筋発育・再生メカニズムになると考えられます。本研究により,エストロゲンの作用機序を調べERβやその下流シグナルの標的を明らかにしたことで,加齢にともなう筋萎縮(サルコペニア)を含む様々な筋脆弱症に対する予防治療開発への展開が期待されます。