

当分野は、骨格筋の発生・再生、適応原理を追究することで、さまざまな筋脆弱症に対する医療技術基盤の創生を目指します。
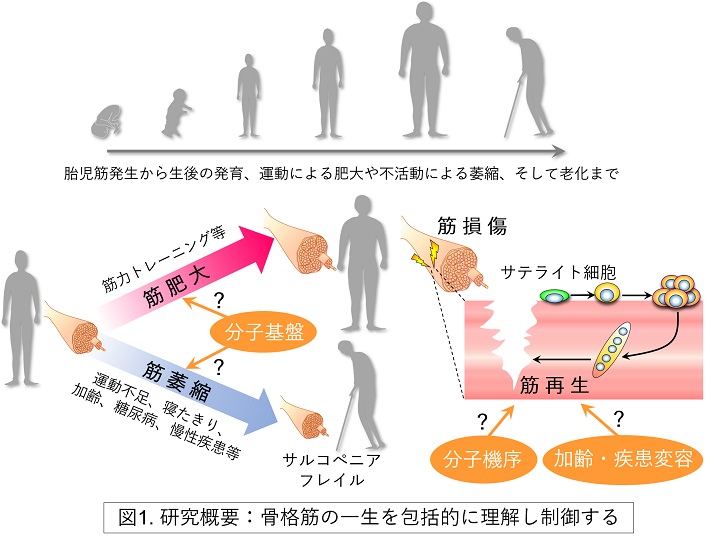
骨格筋は、筋力トレーニング等により負荷をかけると肥大し、逆に、運動不足、長期入院、ギブス固定での生活によって不活動状態が続くと萎縮するといった極めて可塑性に富む組織です。一方、骨格筋は激しい運動や打撲等によって損傷しても速やかに再生されます。この再生には、骨格筋の組織幹細胞であるサテライト細胞の働きが欠かせません。サテライト細胞は、筋再生のみならず、生後の筋肉の成長や筋力トレーニングによる筋肥大においても重要な役割を担います。近年、サテライト細胞が保持する強力な筋再構築能が再認識され、筋ジストロフィーなどの難治性筋疾患への再生治療応用が期待される一方で、加齢や疾患においてサテライト細胞の数や機能自体が低下していることが指摘されています。
近年、我が国をはじめ世界的に高齢化が進行しており、加齢性筋脆弱症(サルコペニア)が社会問題として顕在化してきました。サルコペニアを発症すると日常生活に支障をきたし、転倒骨折や要介護リスクが増大します。骨格筋は体重の4割を占める生体内最大のエネルギー代謝臓器であることから、その量や質の低下は2型糖尿病などの代謝性疾患の発症の引き金になります。また、疫学研究から、筋量・筋力は、心血管系疾患率、がん発症率、認知能低下率、術後の予後等と逆相関し、寿命と正の相関を示すというエビデンスが蓄積されています。最近では、筋量・筋力は、術後の予後や新型コロナウイルス感染症の重症化率を左右するとも言われています。この興味深いエビデンスを説明する背景として、骨格筋の内分泌器官としての役割が注目されています。骨格筋は、恒常的あるいは筋収縮依存的にマイオカインというさまざまな生理活性因子を放出し、脳、肝、脂肪、血管、骨、皮膚等の全身の組織・臓器の代謝や適応・再生に関与することがわかってきました。すなわち骨格筋は、身体動作を司る運動器であり、かつ生命活動の根幹を支える重要な臓器として位置付けられます。したがって、骨格筋の質や量を生涯にわたって健常に維持することは、まさに転ばぬ先の杖となり、人生100年時代を豊かに生き抜くカギになると言えます。
当分野は、サテライト細胞に着目して筋再生の分子基盤を解明し、幹細胞制御による再生医療開発に取り組みます。また、骨格筋の質や量を制御する仕組みを紐解き、加齢や疾患によりその仕組みが破綻するメカニズムをあらゆる角度から包括的かつ統合的に理解することで、筋脆弱症に対する新たな予防治療戦略を構築します(図1)。
(1)サテライト細胞に着目した筋再生の分子メカニズムの解明と筋再生治療法開発
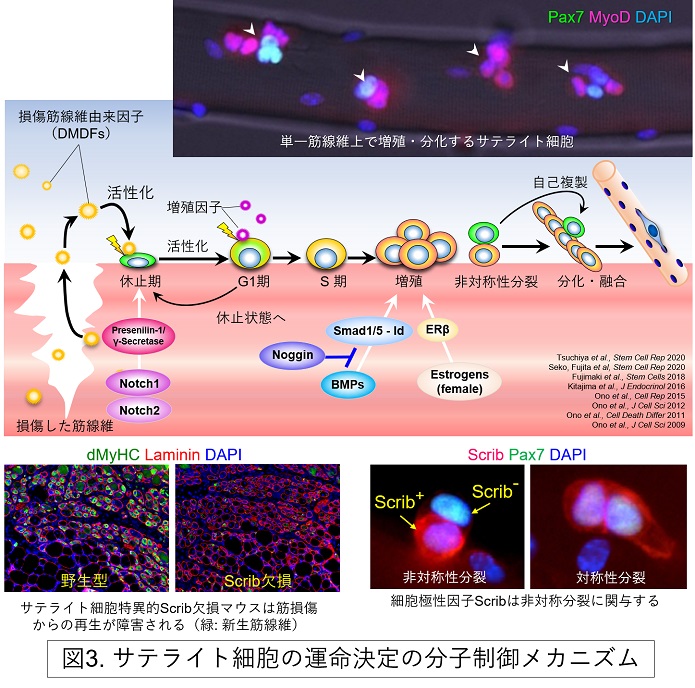
筋幹細胞であるサテライト細胞は強力な筋再構築能を保持するため、筋再生治療への応用が期待されています。サテライト細胞は、生後の筋成長、損傷からの筋再生あるいは筋肥大において重要な役割を担います。成熟した骨格筋は比較的安定した組織であるため、サテライト細胞の恒常的な必要性は低く、サテライト細胞は通常、休止期の状態で存在しています。しかし損傷等の刺激が入ると速やかに活性化し、増殖することで再生に必要な数の筋前駆細胞(筋芽細胞)を生み出します。その後、ほとんどの筋芽細胞は筋分化へ運命付けられ、互いにあるいは既存の筋線維へ融合することで最終分化を遂げます。一方、一部の筋芽細胞は分化せず、再び休止期の状態に戻り自己複製することでサテライト細胞プールを維持します。この自己複製機構により、筋肉を酷使し損傷を繰り返しても、サテライト細胞を枯渇させることなく再生力を維持することができます。サテライト細胞の増殖、分化、自己複製という「運命選択」は巧妙に制御されており、その異常はサルコペニアや筋ジストロフィーなどの筋脆弱症と関連すると考えられています(図2)。
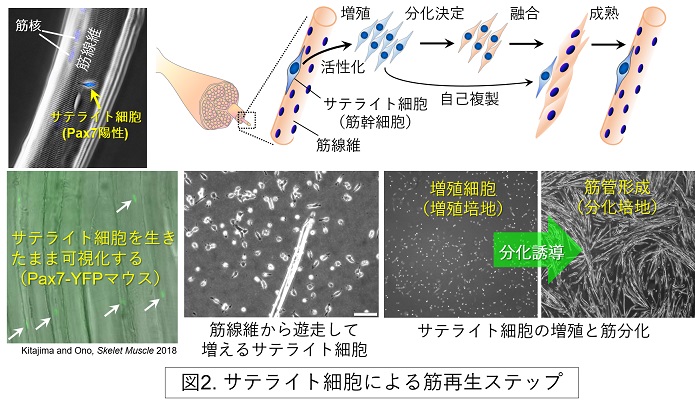
当分野では、サテライト細胞の幹細胞治療応用を目指し、サテライト細胞の増殖、分化、融合、自己複製の運命決定を調節する分子メカニズムの解明に取り組んでいます。その成果の一部として、BMPシグナル (BMP-Smad1/5-Id軸) とBMP阻害因子Nogginが筋再生過程における筋芽細胞の増殖と分化のバランスを調節すること、Notch1/Notch2シグナルは協調して働き休止期サテライト細胞の数を維持すること、細胞極性因子Scribはサテライト細胞の非対称性分裂を制御し、増殖、分化、自己複製の運命選択を発現量依存的にコントロールすること等を報告してきました(J Cell Sci 2009; Cell Death Differ 2011; J Cell Sci 2012; Cell Rep 2015; Physiol Rep 2015; Stem Cells 2018; Stem Cell Rep 2020a; Stem Cell Rep 2020b)(図3)。また、私たちは、サテライト細胞には個性(機能的不均一性)があり、幹細胞としての機能(ステムネス)を保持する細胞は一部の集団に限られること、さらに、骨格筋の部位によってもサテライト細胞の質は大きく異なることを見出しています(Dev Biol 2010; J Cell Sci 2012; Acta Physiol 2011; Sci Adv 2021)。
当分野はサテライト細胞を理解し制御するための新たな培養法の開発にも取り組んでいます(Method Mol Biol 2016; Front Cell Dev Biol 2020; Bio Protoc 2022)。私たちはサテライト細胞の未分化マーカーであるPax7に着目し、内因性のPax7タンパク質をYFPで可視化できるPax7-YFPノックインマウスを作出しました (Skelet Muscle 2018)。当該マウスは、Pax7タンパク質の発現動態や機能解析に応用するとともに、未分化サテライト細胞の生細胞イメージングやFACS分取が可能になり、サテライト細胞研究の強力な解析ツールになると期待されます。
幹細胞を用いた再生治療開発の加速が希求される中、私たちは、サテライト細胞の運命決定の分子制御機構や機能的不均一性を一歩一歩着実に理解していくことが、未来の再生医療実現に向けた土台作りになると考えます。
(2)骨格筋の質と量を制御する分子基盤の解明
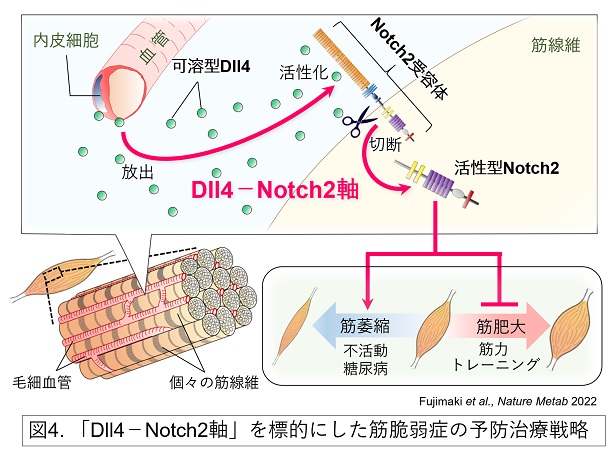
骨格筋は、身体的低活動、糖尿病、加齢、がん、急性・慢性炎症等、さまざまな状態・疾患等により萎縮します。これまで筋萎縮を誘導する上流のメカニズムについてはほとんどわかっていませんでした。近年、私たちは、身体的低活動や糖尿病の状態では血管内皮細胞から、Notchリガンドの1つであるDll4が可溶型で放出され、筋線維に発現するNotch2受容体を活性化し筋萎縮を引き起こす分子機序を発見しました(Nature Metab 2022; Methods Mol Biol 2023)。この成果は、血管由来の可溶型Dll4は、低活動のメカニカルな脱負荷と高血糖のメタボリックな過負荷という異なる状態により誘導される筋萎縮において共通した上流シグナルとして機能することを示すものです(図4)。今後、Dll4-Notch2軸の詳細な分子機序の解明や多臓器連関の視座からサルコペニア・フレイルに対する予防治療法開発を進めていきます。
また、当分野はエストロゲンや甲状腺ホルモンを含む生体内環境によって骨格筋の質や量が制御される側面、(FASEB J 2016; J Endocrinol 2016; Nutrients 2017; Stem Cell Rep 2020b; Acta Physiol 2021)や、骨格筋の異常が他の臓器へ与える影響として多臓器連関(FASEB J 2018; Front Cell Dev Biol 2019)にも焦点を当て、加齢疾患との関連を明らかにしていきます。
(3)ポジショナルメモリーとマッスルメモリーの理解と制御
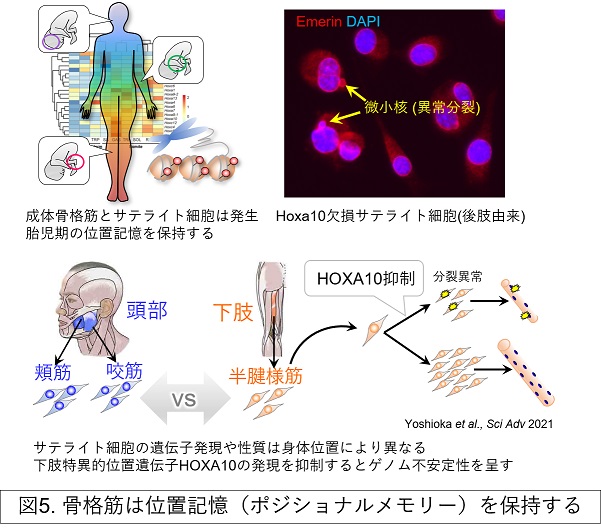
骨格筋の大きさや形状は解剖学的に多様であり、その機能も身体動作のみならず、姿勢維持、呼吸、咀嚼、嚥下、表情表出等と多岐にわたります。近年、骨格筋の性質は全身を通して均一ではないことがわかってきました。当分野では、骨格筋の再生能あるいは加齢や疾患による萎縮感受性は、骨格筋の部位により異なることを報告してきました(Dev Biol 2010; Sci Adv 2021; Acta Physiol 2021)。このことから、高い筋再生能や筋萎縮抵抗性を保持する部位の分子基盤を解明することで、脆弱化しやすい部位を制御するためのヒントが得られると予想しています。また、私たちは、部位特異性の理解の糸口として、胎児発生過程で形成される「位置記憶(ポジショナルメモリー)」が成体の骨格筋およびサテライト細胞に内在(残存)することに着目しています(Sci Adv 2021)(図5)。ポジショナルメモリーの理解と制御を目指し、マウスを用いて全身のさまざまな部位から採取した骨格筋およびサテライト細胞の遺伝子発現アトラスの作成に取り組み、骨格筋の位置情報の全容解明に迫ります。
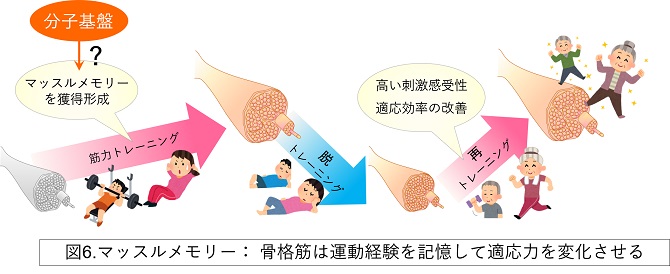
骨格筋は可塑性に富んでおり、レジスタンストレーニング等により負荷をかけると物理的(大きさ)にも化学的(代謝)にも適応変化します。一方、レジスタンストレーニングによる適応効率には個人差があります。この個人差は遺伝的な背景だけでは説明できません。私たちは、個人差を生み出す要因として、過去の活動経験を記憶して維持する骨格筋の後天的な性質変化である「マッスルメモリー」という概念に注目しています(図6)。マッスルメモリーは、身体適応のトレーナビリティーの根幹を支える重要な機能を担っている可能性がありますが、現在は経験的な現象論に留まっています。当分野は、マルチオミクス技術やマウス遺伝学を駆使してマッスルメモリーの分子基盤の解明を進めています。将来的には、マッスルメモリーに介入することで、加齢にともなう肥大適応シグナル伝達障害を改善できるかもしれません。
私たちは、先天的形質であるポジショナルメモリーと、後天的な獲得形質であるマッスルメモリーの両面からアプローチすることで、骨格筋の質を規定する制御機構の頑強性と柔軟性を包括的に理解できると考えています。
(4)筋疾患の病態解明と治療基盤の創出
私たちは、難治性筋疾患である筋ジストロフィーの治療法開発に取り組んでいます。特に、現在治療法のない顔面肩甲上腕型筋ジストロフィー(FSHD)の病態解明に注力しています。FSHDでは本来骨格筋では認められない細胞毒性をもつDUX4という転写因子が骨格筋に異所性に発現することで筋脆弱化を誘導すると考えられています。しかし、DUX4がどのように細胞毒性を発揮し、疾患発症につながるのかは明らかになっていません。FSHDマウスモデルを用いてその病態解明と治療基盤の創出を目指します。
私たちと一緒に骨格筋の謎を解き明かしてくれる大学院生を募集しています(医科学専攻修士課程、医学専攻博士課程)。出身学部や経験は問いません。また、日本学術振興会特別研究員として参画希望の方もお待ちしております。ご興味のある方はお気軽にお問い合わせ下さい。なおPIの小野は東京都健康長寿医療センター研究所 (https://www.tmghig.jp/research/team/kareihenyoh/kinroukaseigyo/)にも所属しており、両ラボは有機的に連携して研究を推進しています。