

減数分裂は、第一分裂に半数化の染色体分配が余分に組み込まれている点が体細胞分裂と異なる。第二分裂は基本的に体細胞分裂と同様の機構が働いているので、基本的には第一分裂が減数分裂と体細胞分裂との違いを決定付けている。とりわけ、減数第一分裂においては体細胞に見られない特有の染色体構造が見られるが、高等動物ではその構成因子について未だ不明な点も多く長年の懸案とされていた。以下に述べるように、当分野長の石黒はマウス生殖細胞の減数分裂期に特異的な染色体因子について研究を行ってきた。奇しくもこれらはすべてデータベースに眠る未解析の因子であったが、欠損マウスの解析から減数分裂における染色体動態の制御に極めて重要な役割を果たしていることが明らかとなった。
体細胞分裂から減数第一分裂への切替えが何によって制御されているのかという問題は、生物種を問わず長年の懸案とされていた。マウスではレチノイン酸に応答して一過的に発現誘導されるSTRA8タンパク質が減数分裂の進行に必須であることが2000年代半ばの先行研究により示唆されていたが、その分子機構の解明は国際的にも攻め倦んでいた。
最近、我々は減数分裂にコミットした生殖細胞集団から効率良くSTRA8を精製できる遺伝子改変マウスを開発し、STRA8と相互作用する新規の因子を同定した。この因子はID番号だけを付されたゲノムに眠る未解析の遺伝子にコードされていた。我々がMEIOSIS initiator (MEIOSIN)と名付けたタンパク質はHMG-likeドメインをもつDNA結合因子と推測されるが、これを欠損させると雄雌ともに精巣・卵巣の萎縮を伴って体細胞分裂から減数分裂への切替えが見らず不妊になる(図7)。このMeiosin を欠損させた精母細胞では、細胞周期の維持に関与する体細胞型Cyclinの異所的発現やM期様染色体構造など体細胞様の特徴を示す細胞の蓄積が観察される。さらにChIP-seq解析により、MEIOSINはSTRA8と複合体を形成して減数分裂関連遺伝子の転写開始点近傍に結合することが判明した。この事実と符合してMeiosin を欠損させた生殖細胞では多くの減数分裂関連遺伝子の発現低下が見られた。興味深いことに、Meiosin欠損マウス卵巣では僅かながらも見かけは卵子によく似たoocyte-like cellが採取される。野生型の卵子がキアズマを持つ20対の二価染色体を示すのに対して、驚くべきことにこのoocyte-like細胞は40本の姉妹染色分体を示すことが判明した。この事実はMeiosin欠損マウスでは、減数分裂のプロセスを経由せずに生き延びた卵子前駆細胞が見かけ卵子様の分化を遂げながらも体細胞と同じ染色体構成を示すことを示唆している。
本研究によりMEIOSINは減数分裂の開始に決定的な役割を担う転写活性化因子であることが明らかとなった。さらに本研究の成果から“減数分裂の細胞周期”が卵子の分化とは遺伝学的に分離されるプロセスであることが強く示唆される。体細胞分裂と減数分裂との本質的な違いを決定付けるメカニズムの全容解明に向けて、国際的にも圧倒的に有利な状況で研究を推進できることが期待される。
実験医学5月号 カレントトピックス38(8)1369-1373,2020.
Veritas https://www.veritastk.co.jp/sciencelibrary/researcher/researcher20.html
Presentation slide (GRC meiosis) https://www.youtube.com/watch?v=47NhxgLdOmQ
精巣では減数分裂が完了すると引き続きプロタミンへの取り込みや核が高度に凝縮されるなど精子形成に特徴的な発生プログラムが進行する。とりわけ精母細胞では減数第一分裂の終盤になると、大規模なヒストン修飾変化、ヒストンバリアントの置換を伴ってそれまで恒常的に活性化されていた多くの遺伝子の発現が不活性化されることが知られている。しかしながら、精子形成過程に先がけて減数分裂仕様の遺伝子発現プログラムを終結させるメカニズムの詳細は不明とされ、解明されていない課題であった。 当研究グループでは、以前減数分裂の開始因子MEIOSINを発見した際に、それによって数百種類におよぶ減数分裂関連遺伝子が一斉に活性化されることを明らかにしていた(Ishiguro et al. Dev Cell 2020)。それらの中には機能未解明のまま手付かずの遺伝子が多く残されていることもわかっていた。そのうちの一つの正体不明の遺伝子ZFP541についてより詳細な解析を行った(Horisawa-Takada Y et al, Nature Commun. 2021)。
免疫染色およびsingle cell RNA-seq解析から、ZFP541は精巣内では減数第一分裂前期の中盤から円形精子細胞までのステージで核に出現することが明らかとなった(図1)。ゲノム編集によりマウスのZfp541遺伝子を欠損させると、オスの精母細胞はいったん減数分裂を進行するものの減数第一分裂前期の終盤で死滅して不妊となることが判明した(図2)。なお卵巣においてもZFP541の発現は見られるが、Zfp541欠損マウスのメス妊性に影響は見られなかった。精巣クロマチン画分からのZFP541タンパク質の免疫沈降と質量分析法を駆使した解析の結果、ZFP541がHDAC1およびKCTD19と複合体を形成することが明らかとなった。KCTD19はPOZ/BTBドメインをもつタンパク質で、ZFP541と同様に精巣に特異的な発現パターンを示す。またKctd19遺伝子を欠損させると、Zfp541欠損マウスと同様に減数第一分裂を完了できずに不妊となることが判明した。さらにChIP-seq解析およびZfp541欠損マウス精母細胞のRNA-seq解析を駆使して、減数第一分裂におけるZFP541の役割を検討した。その結果ZFP541が多くの遺伝子の転写開始点近傍に結合することが判明した。興味深いことに、ZFP541の標的の多くがクロマチン結合因子やヒストン修飾など転写制御に関連するユビキタスなタンパク質をコードする遺伝子であることや、これらが減数第一分裂前期の中盤を境に発現が抑制されることを示唆する結果が得られた。これらの結果から、ZFP541は転写抑制複合体としてクロマチン・エピジェネティクスの制御に関連する遺伝子群の発現を抑制することにより、減数第一分裂前期のプログラムを終結させるように働いていると結論された(図3)。体細胞系譜ではDNAメチル化、ヒストン修飾、ヒストンバリアント置換、非ヒストンクロマチン結合タンパク質によって半保存的なエピゲノム情報複製が連綿と続いている。これとは対照的に、次世代への遺伝情報の伝達に先駆けて雄の減数分裂ではエピゲノム情報が解消される仕組みの一端が本研究で明らかとなった。
当研究室では減数分裂のスイッチを入れる遺伝子MEIOSINを発見した際に、それによって数百種類におよぶ減数分裂に関わる遺伝子が一斉に活性化されることを明らかにしていた(Ishiguro et al. Dev Cell 2020)。それらの中には機能未解明のまま、まだ十分に解明されていない遺伝子が多く残されていることもわかっていた。今回、そのうちの一つの正体不明の遺伝子C19ORF57についてより詳細な解析を行った(Takemoto et al. 2020)。
質量分析法を駆使した解析の結果、C19ORF57がBRCA2と結合することが判明した。先行研究により、乳がん抑制遺伝子産物BRCA2はRAD51リコンビナーゼとともにDNA損傷修復に働く重要な働きがあることが知られていた。C19ORF57は減数分裂組換えの開始時に、BRCA2/RAD51をDSBに呼び寄せる役割を果たしていることが明らかとなった(図1)。
露出したDSB部位には通常single strand DNA(ssDNA)結合因子が結合することが知られている。減数分裂では、通常型のssDNA結合因子(RPA)以外に、減数分裂期に特異的に発現するssDNA結合因子(MEIOB, SPATA22) の存在が知られている。C19ORF57は減数分裂型のssDNA結合因子MEIOB, SPATA22に結合して、BRCA2/RAD51のDSBへのリクルートを調節していることが示唆された。さらにノックアウトマウスを用いた検証の結果、減数分裂組換えの素過程がうまく進行せずに精子形成が不全となることが明らかとなった(図2)。通常、哺乳類細胞ではDSBに対して非相同末端結合(NHEJ)の仕組みによって修復される傾向が高いことが知られている。C19ORF57は減数分裂組換えの際に、相同染色体を鋳型にした相同組換えがより有利に働くように機能していることが推測された。
この研究によりC19ORF57が生殖細胞内のDNA損傷修復で重要な役割を演じていることが示されたが、MEIOSINの指令下で働くことが予想される他の機能未解明の遺伝子の働きについてはまだ十分に解明されていない。今後はこれら他のMEIOSIN標的遺伝子の働きも同時に解明することにより、減数分裂の理解に大いに貢献することが期待される。
図1 減数分裂組換えのときに起きるDNA損傷修復のメカニズム
図2 マウスを使ったゲノム編集によりC19ORF57の働きを阻害する実験
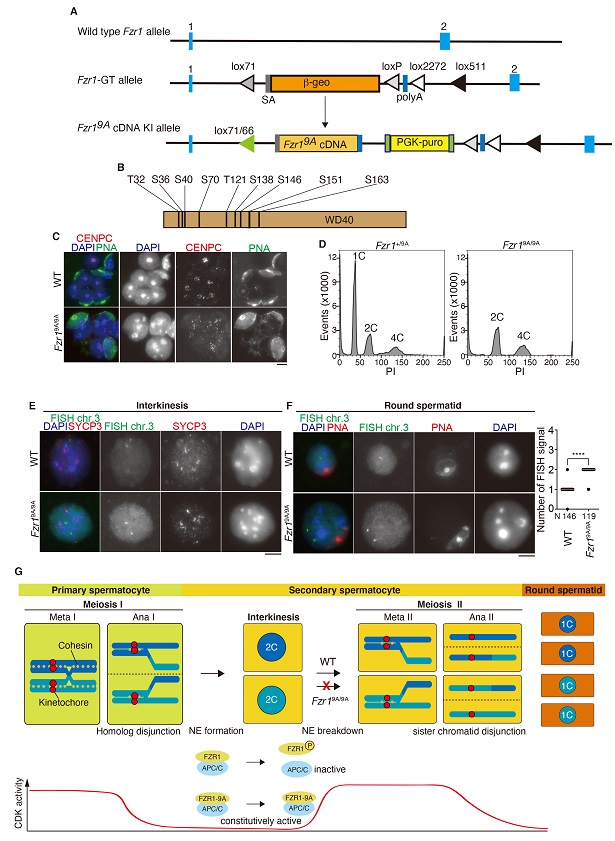
Anaphase promoting complex/Cyclosome (APC/C)は体細胞分裂の細胞周期を駆動するE3ユビキチンリガーゼとして知られる。FZR1(CDH1)はAPC/Cに直接結合して基質選択性を与える活性化因子として働き、細胞周期進行に関連する様々なタンパク質を分解に導く。体細胞分裂型の細胞周期において、FZR1(CDH1)はG2/M期におけるCDK活性の亢進によってリン酸化を受けるとAPC/Cから解離し、CDK活性が低レベルに保たれるG1期ではAPC/Cと結合してその活性化を制御する。我々は、CDKによるFZR1(CDH1)のリン酸化とそれを介したAPC/C活性制御が減数分裂にどのように関与しているのかについて検討を行った(Tanno et al, Scientific Reports 2020 https://doi.org/10.1038/s41598-020-67116-0)。
FZR1(CDH1)内の9箇所のリン酸化部位にアラニン置換を導入し、非リン酸化型を模倣した変異FZR1-9Aを発現するノックインマウス (Fzr19A/9A KI)を作製した(図A, B)。意外なことにFzr19A/9A KIマウスは体細胞組織における体細胞分裂に顕著な異常を示さず、精子形成に異常をきたして雄性不妊を示すことが判明した。この巣内では核型の大きい異形精子前駆細胞の蓄積を伴って停止していることや、半数体1Cに相当する細胞集団が観察されない(図C, D)。さらにFISH解析により染色体分配について検討したところ、この精母細胞では減数第一分裂は正常に完了するものの第二分裂への移行がブロックされていることが判明した(図E, F)。
したがって雄の減数第二分裂への進行にはCDKによるFZR1リン酸化の制御が必要であると結論された(図G)。
興味深いことに、Fzr19A/9A KIマウス雌には顕著な生殖能の異常は観察されず、表現型に性差が見られる。雄の減数分裂では第一分裂と第二分裂との間に核膜再形成と染色体脱凝縮を伴う一過的な間期(interkinesis期)があるのに対して、雌にはそれに対応する時期が存在しない。おそらくCDKの高活性レベルが回復する第二分裂に先駆けて、Fzr19A/9A KIマウスでは恒常的に活性化されたAPC/Cが核膜崩壊と染色体再凝縮に必要とされるタンパク質を過剰に分解するために第二分裂への移行が障害されることが示唆された。
コヒーシン複合体はS期において複製された姉妹染色分体がばらばらとならないように接着する機能とクロマチンloopingによるenhancer-promoter相互作用を介した遺伝子発現制御という2つの大きな機能が知られている。さらに、コヒーシン複合体には体細胞型(RAD21サブユニット型)と減数分裂型 (REC8サブユニット型)の使い分けがある。(J.Cell Science 120 : 367-369, 2007)
マウス生殖細胞クロマチン画分からの質量分析スクリーニングにより、卵巣・精巣で特異的な発現を示す未解析の因子が同定された。これに対する抗体が減数第一分裂の染色体を軸状に染めること、さらにヒーシンサブユニットRAD21と相同性を示す新規の減数分裂型コヒーシンサブユニットであることが判明し、RAD21Like (RAD21L)として公表した(図1)(EMBO rep. 12 : 267-275, 2011)。
減数第一分裂前期においてRAD21L型およびREC8型コヒーシン複合体は染色体上で相互排他的な軸状の局在パターンを示す。減数第一分裂前期には2本の相同染色体が対合して二価染色体が形成されるが、興味深いことに両者の分布パターンは対合しつつある2本の相同染色体間で対称性を示すことが判明した (図2)。これらの観察から、減数第一分裂前期においてRAD21L型およびREC8型コヒーシン複合体はゲノム上でそれぞれ別々のドメインを形成していることが示唆された。 (興味のある方は総説を参照ください。実験医学31, 2578-2585, 2013)
減数第一分裂前期においては染色体上にAxial elementと呼ばれる軸状の構造が形成される(図3)。このような軸状の染色体構造は、体細胞では見られず、減数第一分裂の時だけに見られる特徴の一つである。RAD21Lあるいは REC8いずれかを欠失させると、この軸状の染色体構造の形成が不完全となってしまう。さらにRAD21Lと REC8を同時に欠失させると、この軸状の染色体構造が完全に消失する(図4)。すなわち、減数分裂型のRAD21L およびREC8コヒーシンは、この染色体の軸状構造の形成において骨組みとしての役割を果たしている。
RAD21Lあるいは REC8いずれかを欠失させると、二価染色体の形成過程に支障が生じ雌雄ともに不妊となってしまう(図5)。特定の染色体領域を蛍光標識するimmuno-FISH法を駆使した手法で、不妊を示すさまざまな遺伝子改変マウスと正常個体において相同染色体のペアリングを解析した結果、RAD21Lが破壊されたマウスの生殖細胞では、減数分裂の進行過程で相同染色体のペアリングがまったく起きないことが明らかとなった(Genes&Dev. 594-607, 2014)。RAD21Lコヒーシンタンパク質は、生殖細胞において減数分裂に特化した染色体構造を構築する主要因子でもあることから、相同染色体のペアリングはRAD21Lコヒーシンに依存して構築される構造を介している可能性が示唆された。一方REC8型コヒーシンは減数分裂組換えにおいて、組換えの鋳型を姉妹染色分体ではなく相同染色体にバイアスをかける働きが示唆された。このように減数分裂型コヒーシンは、減数分裂期に特有の染色体構造と相同染色体の相互作用において極めて重要な役割を果たしていることが明らかとなった。 ( http://www.u-tokyo.ac.jp/public/public01_260306_j.html)
体細胞分裂では、姉妹染色分体の動原体がそれぞれ両極から伸びてくるスピンドル微小管によって反対方向の位置から捕捉されることにより姉妹染色分体が反対方向に均等に分配される。これに対して、減数第一分裂では、姉妹染色分体の動原体はあたかも一つの融合した動原体のように振る舞うことで一方向から伸びてくるスピンドル微小管によって捕捉されるようになり、キアズマによって物理的につながった相同染色体がそれぞれ反対方向に分配される。さらに減数第一分裂では、姉妹染色分体のセントロメア領域近傍の接着が維持されることにより動原体同士が接着したままであることが特徴である。
動原体タンパク質CENP-Cの相互作用因子として同定されたMEIKINは、精母細胞、卵母細胞の減数第一分裂前期のパキテン期から第一分裂中期にかけて動原体に局在し、第二分裂時に消失する (図6)。MEIKIN欠損マウスでは、減数第一分裂の進行時に体細胞分裂型の染色体分配様式となってしまうために雌雄共に不妊となる。さらにMEIKINはPolo-like キナーゼとの相互作用により、減数第一分裂の動原体制御を担っていることが結論された(Nature 517, 466-471,2015)。
(興味のある方は総説を参照ください。実験医学33, 1427-1431,2015 : ライフサイエンス新着論文レビュー, 2015 http://first.lifesciencedb.jp/archives/9704)