

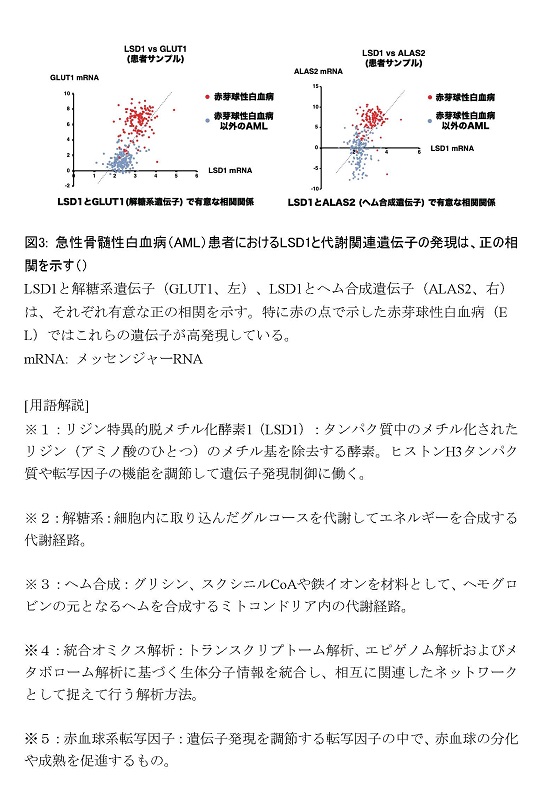
ポイント
概要説明
熊本大学発生医学研究所 細胞医学分野の衛藤 貫特任助教、中尾光善教授らは、網羅的な遺伝子解析を用いて、老化細胞による炎症反応を促進する酵素とその阻害効果を初めて発見しました。「ACLY※1」は細胞内でクエン酸からアセチルCoAを合成する代謝酵素で、細胞の活動と遺伝子の働きを調節することが知られています。今回、老化細胞※2においてACLYの量が増加すること、また、老化細胞でACLYを阻害すると炎症性タンパク質の遺伝子の働きが強く抑制されることが分かりました。ACLYによって合成されたアセチルCoAは炎症性タンパク質の遺伝子を活性化するエンハンサー領域※3のヒストンのアセチル化※4に使われ、さらにアセチル化ヒストンに結合するBRD4※5が働くことを明らかにしました。老齢マウスにACLYまたはBRD4に対する阻害薬剤を用いたところ、転写因子STAT1※6を介するインターフェロン経路が抑制されて、慢性炎症が抑制されることを見出しました。
この成果では、老化細胞でACLYが炎症性タンパク質の合成・分泌を促進するメカニズムを明らかにしたことから、細胞老化による慢性炎症の制御法(セノスタティクス※7)の開発につながることが期待されます。
本研究成果は、文部科学省科学研究費補助金、文部科学省共同利用・共同研究システム形成事業「学際領域展開ハブ形成プログラム」、熊本大学発生医学研究所の高深度オミクス医学研究拠点ネットワーク形成事業、株式会社村上農園研究経費の支援を受けて、科学雑誌「セル・リポート(Cell Reports)」オンライン版に米国(ET)時間の令和6年7月22日(日本時間の7月23日)に掲載されました。
研究の内容及び成果
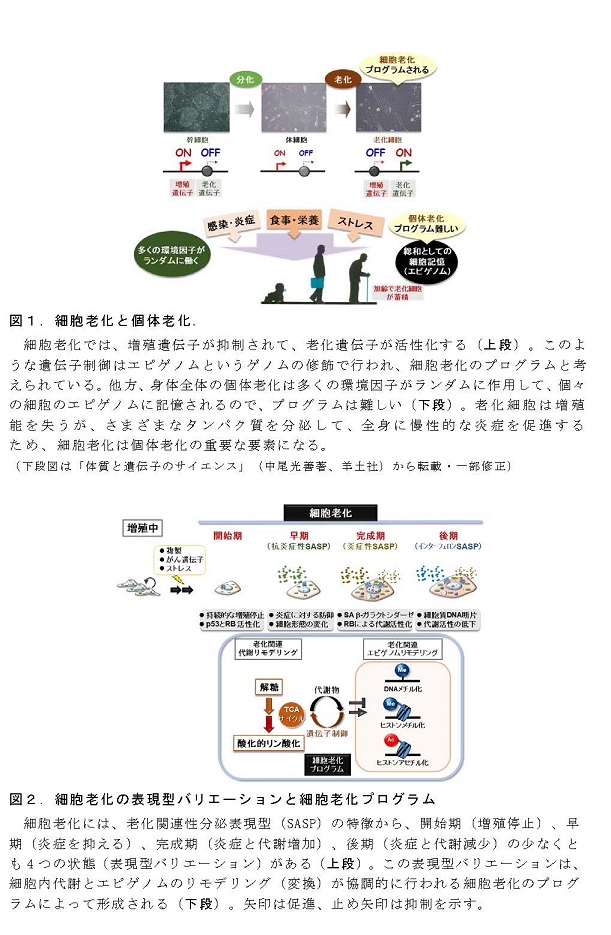
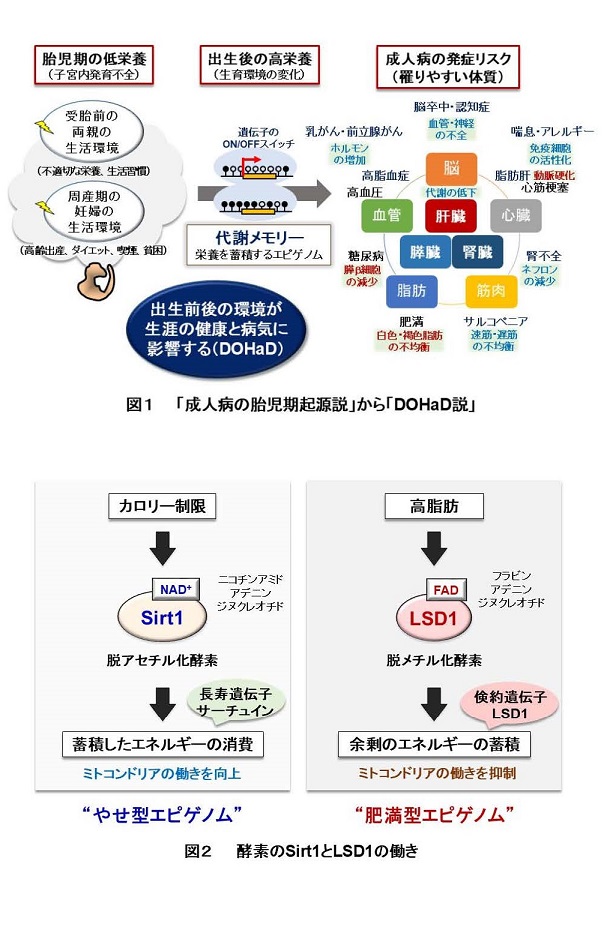
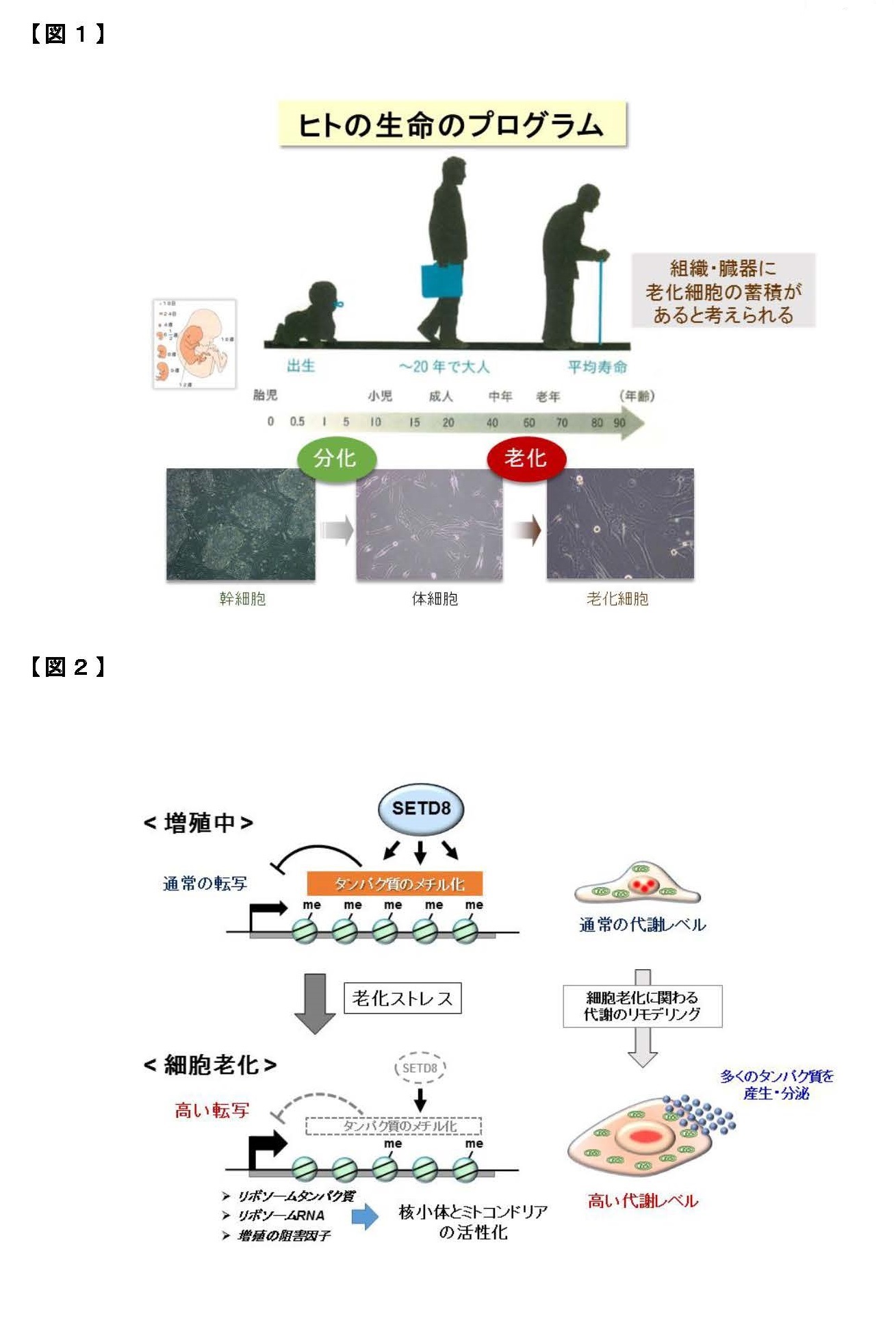
我が国の高齢化は、世界に類を見ないスピードで進展し、今後も延長した平均寿命が続くことから、“健康を維持しながら老いる”健康寿命が重要になっています。身体を構成する多くの細胞は、分裂を繰り返して増えると、やがてその細胞自体の機能は低下して増殖を停止します。これを「細胞老化」とよんで、全身の老化と慢性炎症に関わる重要な要素と考えられています【図1】。細胞老化は、放射線や紫外線などの物理的なストレス、薬剤などの化学的なストレスによってゲノムDNAが損傷を受けると促進されることが知られていますが、老化のメカニズムはまだよく分かっていません。しかも、細胞老化には良い点も悪い点もあります。細胞が「がん化」を始めると、細胞老化が生じてがんの発生を防ぐ役割をしています。他方、細胞老化によって多くの病気(認知症、糖尿病、動脈硬化など)が起こりやすくなります。したがって、細胞老化は適切に制御されることが重要です。
老化細胞は増殖能を失いますが、近年、老化細胞がさまざまな炎症性タンパク質(サイトカイン、ケモカインとよばれます)を分泌して周囲の細胞に働きかけて、慢性的な炎症やがん細胞の増殖を促進することが注目されています。この特徴は細胞老化関連性分泌表現型(SASP)とよばれています。このように、老化細胞はアクティブに働いているので、細胞老化は、身体全体の老化の原因になると考えられるわけです。例えば、老齢マウスの体内には老化細胞が蓄積していきますが、これらを除去すると全身の老化が抑えられて改善するという報告があります。このため、薬剤による「セノリティクス」(老化細胞除去)が注目されています。ところが、体の中で老化細胞は一定の役割を果たしていて、老化細胞が除去されると、その隙間を埋めるように組織の線維化が進んで機能低下するという報告もあるため、世界中でさまざまな研究が進行中にあります。つまり、細胞老化とSASPを制御できれば、全身の老化の進度を調節できる可能性があります【図1】。
本研究グループは、「エピジェネティクス」とよばれる学問の観点から、細胞老化のメカニズムについて研究を進めています。エピジェネティクスは、すべての遺伝子の働き方(ON/OFF)を明らかにする研究分野であり、生命現象や病気の発症、さらに老化にも密接に関わると考えられます。ヒトの設計図に当たるゲノムには、約2万5千個の遺伝子があります。我々はヒト線維芽細胞(すべての組織・器官に存在する細胞種)の老化に関わる因子を幅広くスクリーニングして、複数の因子を同定しました。現在までに、老化細胞では「RBがん抑制タンパク質」によってミトコンドリアの代謝機能が著しく上昇していること(2015年)、「SETD8メチル基転移酵素」および「NSD2メチル基転移酵素」などが細胞老化を防ぐ役割をもつこと(2017年、2020年)を報告しました。
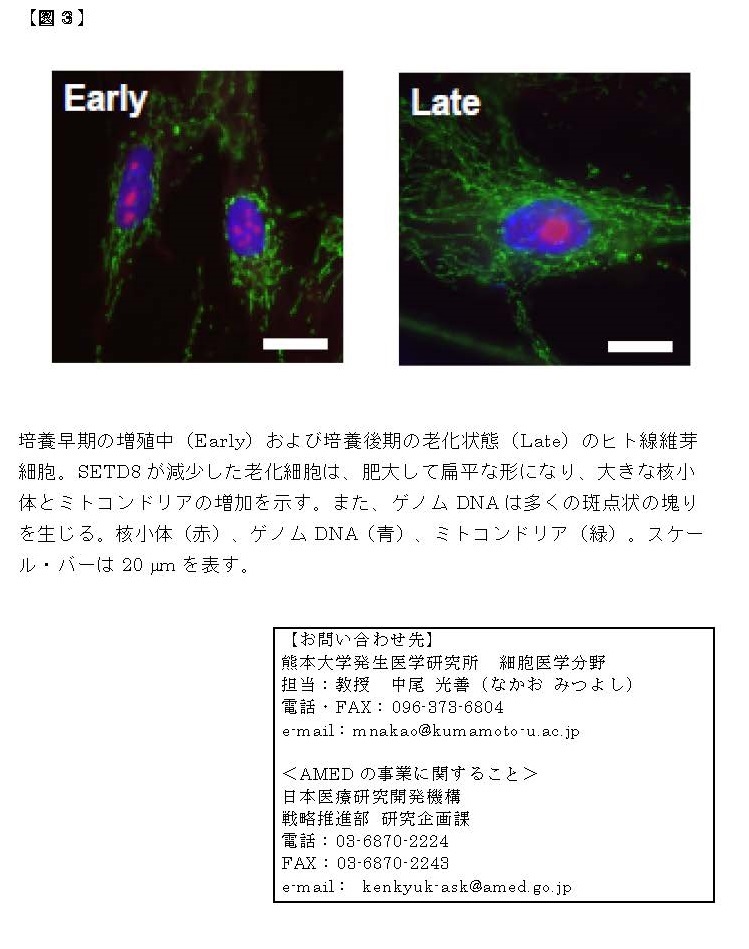
正常な細胞は、何度も分裂して複製した後に増殖を停止します(複製後の細胞老化)。また、がん遺伝子が活性化してがん化が始まると、それを阻止するために老化がおこります(がん遺伝子で誘導される細胞老化)。最新のシークエンサー解析とバイオ情報解析を用いて、すべての遺伝子発現を網羅的に調べる中で、「ACLY」(クエン酸からアセチルCoAを合成する酵素)が増加することを見出しました【図2】。これまで、ACLYはアセチルCoAを用いた細胞代謝やヒストンのアセチル化を通して遺伝子の働きを調節することが報告されています。とりわけ、ゲノムDNAに巻き付く「ヒストン」タンパク質がアセチル化されて、その近傍の遺伝子の働きを促すことが知られています。しかし、ACLYと細胞老化の関連性や標的となる遺伝子群は分かっていません。そこで、線維芽細胞において、ACLYの遺伝子の働きを抑えるノックダウン(RNA干渉法)を行ったところ、細胞老化の途上の細胞および完成した老化細胞で、炎症性タンパク質の遺伝子の働きが選択的に抑制されることが分かりました。つまりSASPが選択的に阻止されました。さらに、ACLYの酵素活性を阻害する薬剤を用いると、同様にSASPと炎症反応が抑制されることを確認しました。つまり、ACLY阻害で細胞老化のSASPが阻止されることが明らかになりました。
次に、老化細胞におけるACLYの役割を詳しく調べた結果、①ACLYが働いてヒストンがアセチル化されると、アセチル化ヒストンに結合するBRD4タンパク質が働いて、炎症性タンパク質の遺伝子の働きが促進されること、②ACLY阻害剤またはBRD4阻害剤を用いて、老齢マウスの炎症反応が抑制できること、③とくに老齢マウス(80週齢)の肝臓や腎臓で、転写因子STAT1を介するインターフェロン経路が抑制されて炎症が抑制されること、が分かりました。老化細胞では、炎症性タンパク質の遺伝子近傍に位置するヒストンがACLY由来のアセチルCoAを用いてアセチル化されているわけです。このため、ACLY阻害剤またはBRD4阻害剤を用いて、慢性炎症を引き起こすSASPが選択的に阻害されること(セノスタティクス)が明らかになりました【図3】。
今回の研究成果は、ACLYが細胞老化のSASPを確立・維持するという発見を契機として、細胞老化の基本メカニズムを明らかにしたものです。細胞老化のしくみ解明や、老化細胞を維持したまま、慢性炎症を引き起こすSASPだけを選択的に制御する手法の開発に役立つと期待できます。
用語解説
※1:ACLY:細胞内でクエン酸からアセチルCoAを合成する代謝酵素で、細胞代謝と遺伝子の働きを調節する。
※2:老化細胞:増殖を持続的に停止した状態の細胞を老化細胞という。体内に蓄積して活発な活動を行うため、細胞死とは異なる。
※3:エンハンサー:ゲノム上の遺伝子の働きを促進するDNA配列。特定の転写因子(DNA結合タンパク質)が結合する。
※4:ヒストンのアセチル化:アセチルCoAを用いてアセチル基転移酵素がヒストンタンパク質を修飾する。近傍の遺伝子の働きを活性化する。
※5:BRD4:アセチル化されたヒストンに結合するタンパク質で、遺伝子の働きを活性化する。
※6:STAT1:細胞がインターフェロンなどの炎症性タンパク質に暴露された場合に働く転写因子。
※7:セノスタティクス:老化細胞は保持して炎症反応を選択的に制御する方法。近年、薬剤によるセノリティクス(老化細胞除去)が注目されるが、老化細胞を除去すると組織の線維化が生じるという報告がある。セノ(老化)+リティクス(分解)、スタティクス(静力学)の造語。
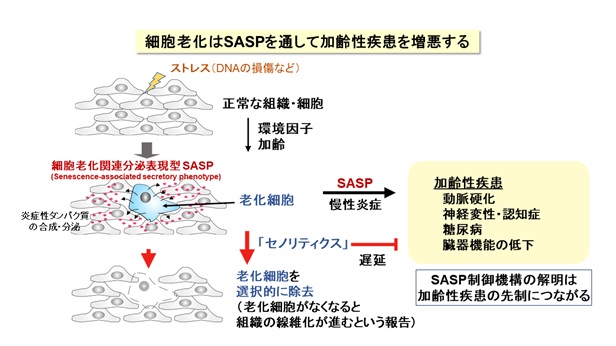
図1
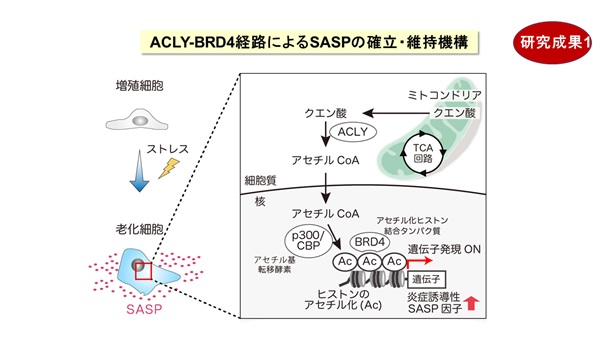
図2
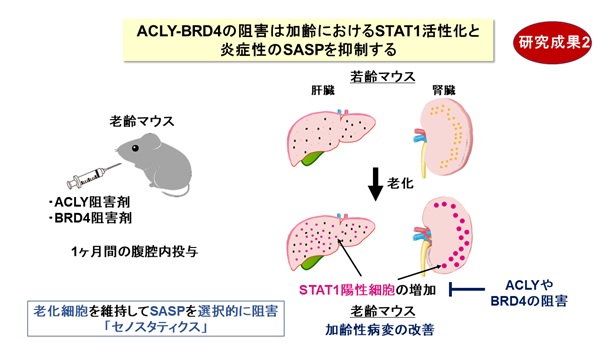
図3
ポイント
概要説明
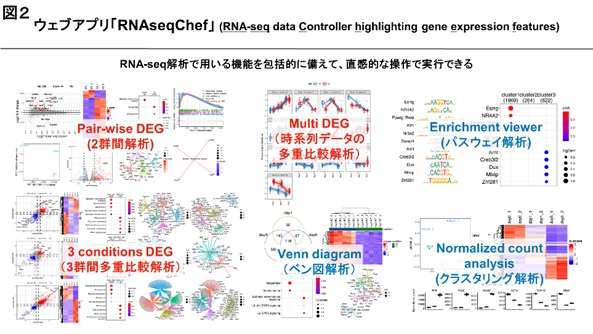
熊本大学発生医学研究所細胞医学分野の衛藤 貫研究員と中尾光善教授は、プログラミング言語を用いて、RNAシークエンス(RNA-seq)法により取得した遺伝子の発現情報を自動的に解析するウェブアプリ「RNAseqChef」を新たに開発・公開しました(http://imeg-ku.shinyapps.io/RNAseqChef)。RNA-seq法は遺伝子の働きを調べる上で、生命科学分野において幅広く用いられる基本的な技術です。国内外の公共データベースには様々な細胞・組織のRNA-seqデータが集約されていますが、情報科学の専門知識が必要なため、多くの研究者が利用するにはハードルがあります。本研究により、情報科学の習得の有無にかかわらず、学生・初心者、医師及び産官学の研究者を含めて、再現性のあるRNA-seqデータの解析が簡便に効率よく可能になります。
ブロッコリー等に含まれる天然化合物「スルフォラファン」は抗酸化や抗炎症、抗肥満など、健康増進につながる多様な効果を有することが報告されています。その一方で、スルフォラファンが細胞・組織に対してどのようなメカニズムで作用するのかは明らかでありません。RNAseqChefの科学的な有用性を実証するために、公共データベースの中から、スルフォラファンを投与したヒト培養細胞とマウスで取得されたRNA-seqデータを解析しました。その結果、細胞・組織の種類によってスルフォラファンへの感受性や応答が異なることが明らかになりました。さらに、スルフォラファンの作用機序として、抗酸化を促進する制御因子「NRF2」を活性化することが唯一知られています。RNAseqChefによる解析で、小胞体ストレス応答を誘導する制御因子「ATF6」を活性化することが明らかになりました。高脂肪食による肥満マウスにスルフォラファンを投与して得られたRNA-seqデータを調べたところ、肝臓特異的に小胞体ストレス応答の遺伝子発現が促進されることが分かりました。スルフォラファンが生体機能を高める分子機序の解明につながると考えられます。
RNAseqChefを無償公開することで、遺伝子発現のビックデータが上記のように簡便に効率よく解析可能となり、医学・薬学・農学などの幅広い生命科学分野の研究の加速、とりわけ、臨床研究のデータ解析、化合物・薬剤の作用機序の解明などへの貢献が期待されます。
本研究成果は、文部科学省科学研究費助成事業、熊本大学発生医学研究所高深度オミクス事業研究助成などの支援を受けて、米国生化学・分子生物学会誌「Journal of Biological Chemistry(JBC)」オンライン版に英国(GMT)時間の令和5年5月11日【日本時間の5月12日】に掲載されました。また、本研究成果はJBCの「Editors’ Picks」にも選ばれました。
研究の内容及び成果
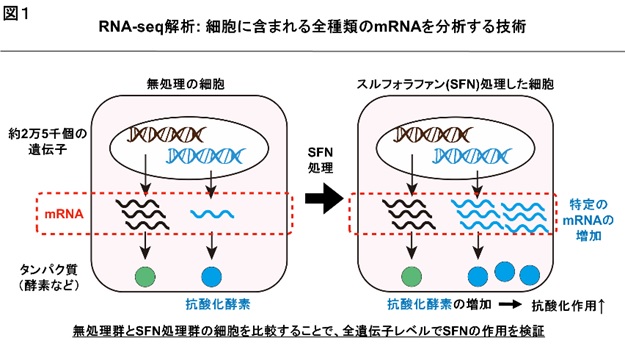
私たちの体を構成する細胞はヒトゲノム上の約2万5千個の遺伝子の中から必要な遺伝子を選択して、mRNAを合成し、それを鋳型にしてタンパク質を合成しています。RNA-seq法は細胞に含まれる全てのmRNAの種類と量を調べることができるので、例えば、無処理の細胞と化合物を処理した細胞を比較することで全遺伝子レベルで化合物の影響を検証することができます【図1】。また、異なる細胞・組織のRNA-seqデータを比較検討することで、細胞・組織特異的な効果を明らかにすることができます。このため、RNA-seqのデータ解析は、医学・生命科学研究に欠かせない基本的な技術になっています。現在、10万程度のデータセットが国内外の公共データベースに集約されており、今後も飛躍的に増加することから、極めて有益な情報源になります。その一方、RNA-seqのデータ解析には情報科学の専門知識が不可欠であるため、簡単には活用できないという問題があります。そこで、この問題を解決するために、全遺伝子の発現変動を自動的に解析・可視化するウェブアプリ「RNAseqChef」※1を新たに開発しました。専門的になりますが、RNAseqChefは、2群間の比較解析や3群間の多重比較解析、時系列データの多重比較解析、ベン図解析、エンリッチメント解析など、RNA-seq解析に用いられる機能を包括的に備えており、しかも直感的な操作で利用することができます【図2】。
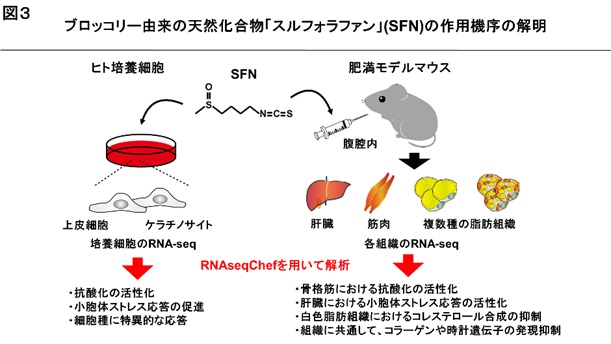
「スルフォラファン」は、ブロッコリー等の野菜に含まれる栄養成分(イソチオシアネートと呼ばれる一種)で、最近、健康増進に注目される天然化合物です。国内外の研究により、スルフォラファンには抗酸化、抗炎症、抗肥満などの多様な効果を持つことが報告されています。他方、癌細胞はスルフォラファンにより細胞死が誘導されるなど、その作用機序の解明が望まれています。そこで、公共データベースに登録されているRNA-seqデータの統合解析により、スルフォラファンの機能の解明を目指しました。
スルフォラファンで処理したヒト培養細胞(上皮細胞及びケラチノサイト)を用いたRNA-seqデータを解析しました。その結果、両方の細胞に共通するスルフォラファンの作用として、既に知られているように、転写因子NRF2※2を介した抗酸化の活性化を確認しました。さらに、NRF2には依存せず、小胞体ストレス応答が促進されることが分かりました。小胞体ストレス応答は、小胞体内に生じた不良タンパク質の折りたたみや分解を促す役割があります。小胞体ストレス応答の異常は、神経変性疾患や肥満を起こすことが知られています。
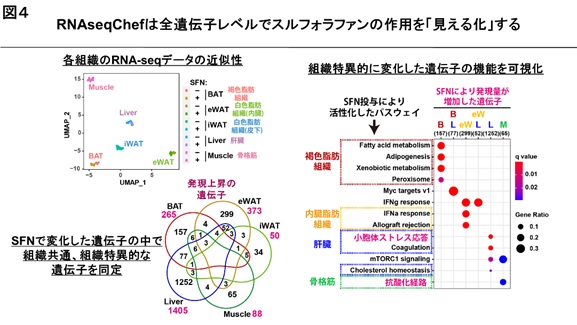
次に、高脂肪食による肥満モデルマウスにスルフォラファンを投与した場合のRNA-seqデータを解析しました。肝臓、白色脂肪組織、褐色脂肪組織及び骨格筋の計5種類の組織のデータを用いました。その結果、スルフォラファンは、肝臓で小胞体ストレス応答とその制御因子ATF6※3の活性化、骨格筋で抗酸化とその制御因子NRF2の活性化を起こすことが分かりました。また、白色脂肪組織では、コレステロール合成経路を抑制することが分かりました。全ての組織に共通した作用として、コラーゲンや時計遺伝子の発現抑制が確認されました【図3】。
RNAseqChefの解析を用いて、スルフォラファンは、肝臓でATF6が小胞体ストレス応答を活性化して脂肪肝や肥満を抑制すること、また線維化に関わるコラーゲンの遺伝子を抑制することが示唆されました【図4】。
本研究グループは、「エピジェネティクス」とよばれる学問の観点から、ゲノム上の遺伝子の働き方(ON/OFF)、健康と病気のメカニズムについて研究を進めています。今回の研究で開発したRNAseqChefは、すべての研究者・臨床医など、国内外のユーザーがRNA-seqデータ解析を速やかに実施できるウェブアプリであるため、生命科学分野で幅広い研究に貢献することが期待されます。
用語解説
※1:RNAseqChef
RNAシークエンスのデータ解析を統合的に実行して可視化する新規ウエブアプリケーション。無償公開することで、国内外の医学・生命科学研究の促進が期待できる。
※2:NRF2
NRF2は酸化ストレスに応答してはたらく転写因子。活性化すると抗酸化作用を持つ遺伝子発現を促進することで細胞を保護する役割を持つ。
※3:ATF6
ATF6は小胞体ストレスに応答してはたらく転写因子。活性化するとタンパク質の折りたたみを補助する遺伝子や不良タンパク質を分解する遺伝子発現を促進することで細胞を保護する役割を持つ。
論文情報
論文名:A web-based integrative transcriptome analysis, RNAseqChef, uncovers cell/tissue type-dependent action of sulforaphane
(トランスクリプトームの統合解析ウェブアプリRNAseqChefは細胞・組織特異的なスルフォラファンの作用を明らかにする)
著者名(*責任著者):Kan Etoh and Mitsuyoshi Nakao*
掲載雑誌:Journal of Biological Chemistry
DOI:10.1016/j.jbc.2023.104810
URL:https://www.sciencedirect.com/science/article/pii/S0021925823018380
ポイント
•遺伝子発現調節タンパク質であるLSD1が筋肉の環境ストレス応答を緩和することで、過剰な環境適応を防ぐことがわかりました。
•骨格筋でのみLSD1を欠損するマウス(LSD1-mKOマウス)に筋萎縮誘導性の薬剤デキサメタゾンを投与すると、野生型マウスと比較してより顕著な筋萎縮を起こし筋力が低下しました。
•自発運動トレーニングによる持久力向上効果は、野生型と比較してLSD1-mKOマウスで増強されました。
•マウスやヒトの筋肉でLSD1量は加齢と共に減少することから、LSD1は加齢に伴うストレス感受性の変化に関与している可能性があります。
概要説明
熊本大学発生医学研究所細胞医学分野の荒木裕貴研究員、日野信次朗准教授、中尾光善教授らは、遺伝子発現に関わる酵素「リジン特異的脱メチル化酵素1(LSD1)※1」が筋肉の環境ストレス感受性を調節する因子であることを明らかにしました。
筋肉は、運動や食事等のさまざまな環境因子によって量や質が調節されますが、このような性質を司る遺伝子機能調節の仕組みはよくわかっていませんでした。
この成果は、筋肉の環境適応メカニズムの一端を解明するものであり、筋肉の機能維持による健康寿命延伸を実現する上で重要な手掛かりになります。
本研究成果は、文部科学省科学研究費補助金、中冨健康科学振興財団研究助成、武田科学振興財団研究助成などの支援を受けて、オンライン科学雑誌「eLife」に米国時間の令和5年1月26日に掲載されました。なお、本研究は熊本大学発生医学研究所筋発生再生分野の小野悠介教授、同大学大学院生命科学研究部代謝内科学分野の荒木栄一教授らとの共同研究で行ったものです。
説明
[背景]
筋肉(骨格筋)は全身の運動機能や恒常性維持に必須の役割を果たします。筋肉は、加齢や栄養、運動などの環境によって肥大したり萎縮したりします。このような変化は環境適応の一環と考えられますが、過度な環境ストレスは、ときに過剰な適応を誘発し、病的な状態を生み出してしまいます。例えば、栄養不足や運動不足などの環境ストレスによって骨格筋は萎縮してしまい、身体能力が低下してしまいます。栄養摂取や運動などの生活習慣により筋肉の機能を維持できれば、健康寿命の延伸や介護負担の軽減が可能となり、保健医療に大きく貢献できます。
遺伝子には様々な「目印」が付けられており、その種類によって発現のon/offや量が決められます。このような目印は「エピゲノム」と呼ばれ、DNAやDNAが巻きついているヒストンタンパク質の化学修飾(メチル基、アセチル基など)が知られています。エピゲノムは環境ストレスによって付け替えられるため、生物の環境適応や長期的な体質形成に重要な役割を果たすと考えられています。しかし、筋肉の環境ストレス感受性に関わるエピゲノム制御の仕組みはあまり分かっていませんでした。
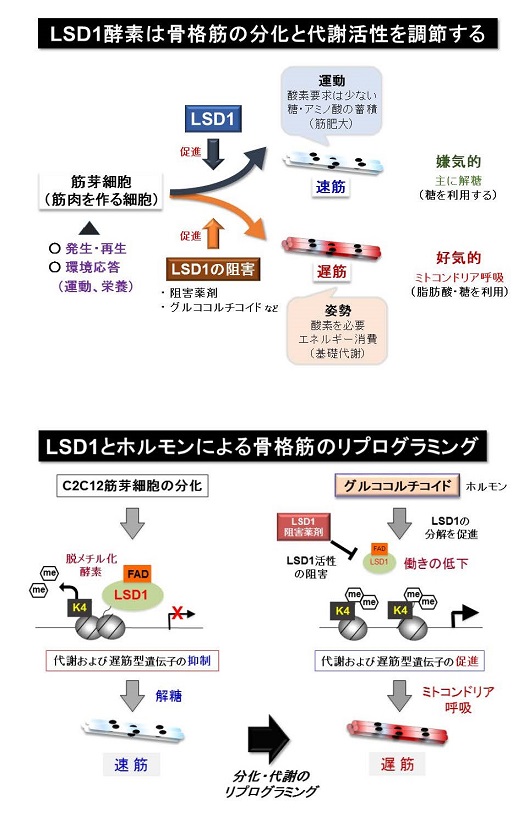
本研究グループは、これまでの研究でエピゲノムの「目印」の一つであるメチル基をヒストンから取り外す酵素「LSD1」の働きを調べてきました。(Nature Communications 2012,Cancer Research 2015, Nucleic Acids Research 2018, Blood Advances 2021)。その過程で、LSD1が速筋と呼ばれる糖代謝の活発な筋線維型の形成を促進することを明らかにしました (Nucleic Acids Research 2018)。この研究で、LSD1が筋肉の健康維持に関わることが予想されましたが、詳細は不明でした。
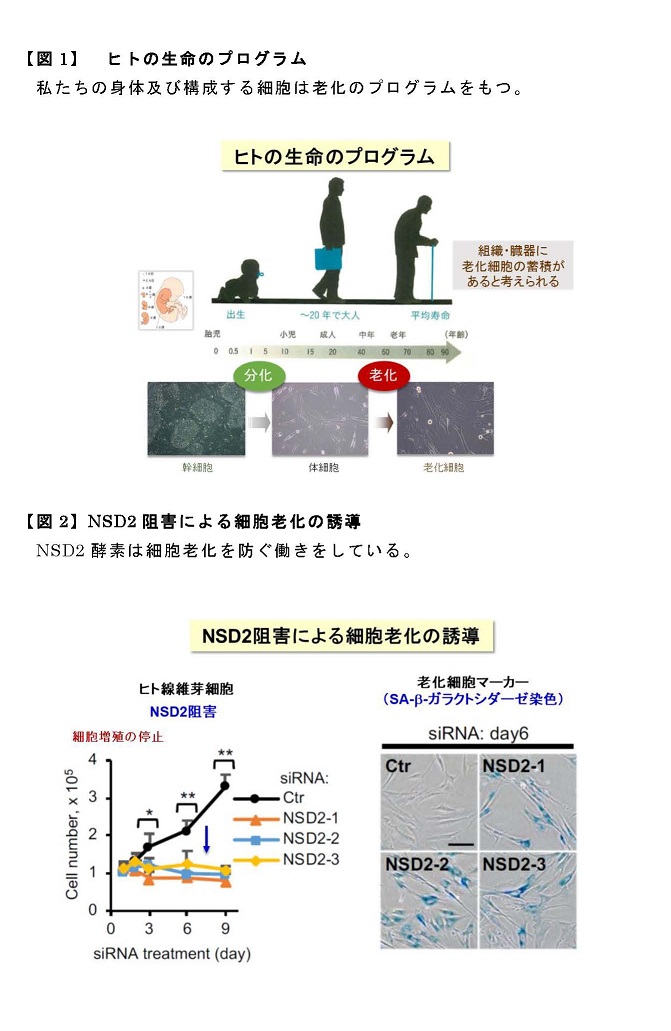
[研究の内容・成果]
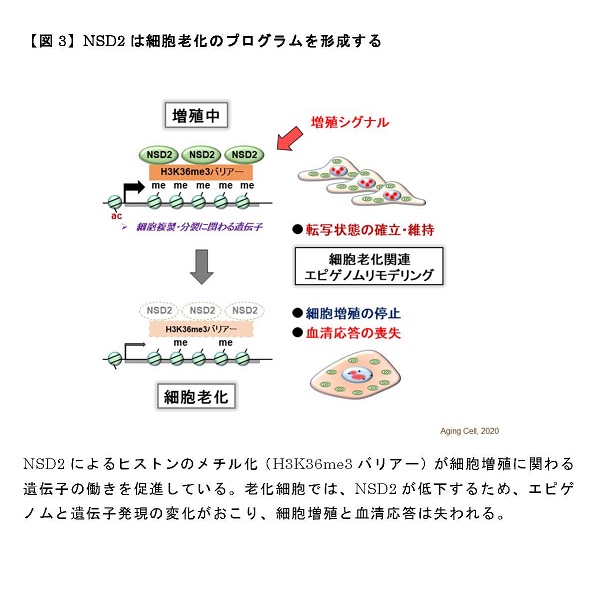
本研究では、上記のような筋肉の環境応答性の調節と健康維持にLSD1が関わる可能性を検討する目的で、骨格筋でのみLSD1を欠損させた(LSD1-mKO)マウスを作製し、環境刺激に対する応答性を検討しました(図1)。飢餓応答ホルモンであるグルココルチコイド(GC)として働く薬剤デキサメタゾンは、瞬発的に大きな力を生み出すアウターマッスルの萎縮と筋力低下を惹起します。LSD1-mKOマウスにデキサメタゾンを投与して筋萎縮を起こさせると、野生型マウスに投与した時よりも重い症状を呈しました。LSD1がなくなると筋萎縮を抑制する働きを持つ転写因子※2Foxk1の働きが抑えられ、その結果筋萎縮遺伝子の発現が亢進することが症状悪化の一因であることが分かりました(図2)。
また、マウスに長期間自発運動トレーニングをさせると持久力の向上や姿勢維持に関わるインナーマッスルが大きくなることが知られていますが、LSD1欠損によりこれらの自発運動効果は促進されることが分かりました。自発運動下のLSD1-mKOマウスでは、好気呼吸※3を活性化する転写因子ERRγの発現量が顕著に増加しており、このことが運動効果促進に繋がったと考えられます(図2)。
これらの結果から、LSD1を欠損すると、環境ストレスに対して筋肉が過剰に応答することがわかりました。つまり、LSD1は環境ストレスに対する急激な応答を緩和することで、骨格筋の適度な環境適応を可能にしていると考えられます。
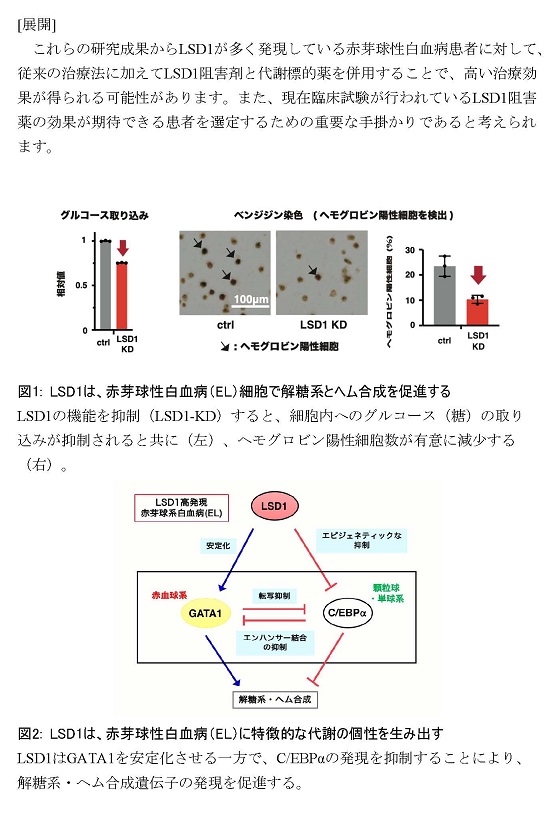
[展開]
本成果には、医学生物学の観点からいくつかの重要な意味があります。加齢に伴ってアウターマッスル量が減り筋力が低下するサルコペニアと呼ばれる病態は、高齢者の生活の質を著しく低下させる要因となります。マウスとヒトの筋肉におけるLSD1の発現は年齢とともに低下し(図3)、筋萎縮遺伝子の発現と負の相関を示します。生活習慣や薬剤によってLSD1を増やして活性化することができれば、筋肉の健康維持に繋がる可能性があります。一方、持久トレーニング時にLSD1機能を抑制できれば、インナーマッスル量の低下を特徴とする廃用性萎縮(筋肉を長期間使用しないことで起こる筋力低下)の予防と管理に有益である可能性があります。ライフステージや生活環境に応じてLSD1機能をコントロールすることで、健康長寿のための新しい戦略が期待できます。
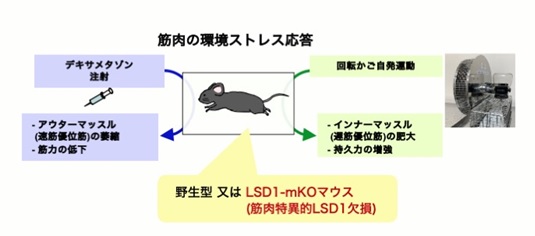
図1: 骨格筋特異的LSD1欠損マウスに環境ストレスを負荷する実験
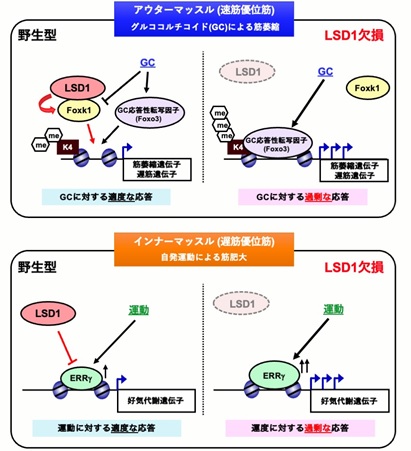
図2: モデル図:LSD1による環境ストレスの緩和と環境適応調節
図3: マウスとヒトにおけるLSD1量の加齢変化(拡大可)
用語解説
※1:リジン特異的脱メチル化酵素1(LSD1):タンパク質中のメチル化されたリジン(アミノ酸のひとつ)のメチル基を除去する酵素。ヒストンH3タンパク質や転写因子の機能を調節して遺伝子発現制御に働く。
※2:転写因子:ゲノムDNAに結合して遺伝子発現のon/offや発現量を調節するタンパク質群。細胞や遺伝子の種類によって異なる転写因子が働く。
※3:好気呼吸:細胞活動に必要なエネルギーを作り出す仕組みのうち、ミトコンドリアの電子伝達系を使う経路。栄養素分解と酸素消費を共役させることで大量のATPを効率的に合成できる。有酸素運動時の筋肉で活性化される。
論文情報
論文名:LSD1 defines the fiber type-selective responsiveness to environmental stress in skeletal muscle
(LSD1は、骨格筋における線維型選択的な環境応答を規定する)
著者:Hirotaka Araki, Shinjiro Hino*, Kotaro Anan, Kanji Kuribayashi, Kan Etoh, Daiki Seko, Ryuta Takase, Kensaku Kohrogi, Yuko Hino, Yusuke Ono, Eiichi Araki, and Mitsuyoshi Nakao* (* 責任著者 )
掲載誌: eLife
doi:10.7554/eLife.84618
URL:https://elifesciences.org/articles/84618
ポイント
概要説明
熊本大学発生医学研究所細胞医学分野の中尾光善教授、日野裕子技術支援者、日野信次朗准教授らは、網羅的な遺伝子発現解析技術を用いて、ミトコンドリア機能不全に陥った肝臓細胞はc-JUNとYAP1により細胞内シグナリングを活性化して、AREGなどのタンパク質を産生・分泌することを初めて発見しました。c-JUNとYAP1は細胞内外の環境の変化に応答して標的遺伝子のはたらきを調節する転写因子です。また、AREGは細胞の増殖などを調節する分泌タンパク質です。本研究により、ミトコンドリアにストレスを受けた細胞は、特定のタンパク質を産生・分泌する状態(分泌表現型)に転換して、周りの細胞にメッセージを出すことが分かりました。
一方、特に近年増加している「非アルコール性脂肪肝炎」(NASH:ナッシュ)や「非アルコール性肝疾患」(NAFLD:ナッフルド)の発症には、肝臓細胞のミトコンドリア機能不全が密接に関わることが知られています。それらのモデルマウスおよびヒトの肝臓検体を調べたところ、ミトコンドリア機能を調節する転写因子TFAM※3の発現が低下しているとともに、AREGの遺伝子発現が増加していることを確認しました。
今回、ミトコンドリア機能不全に陥った肝臓細胞が分泌表現型に換わるメカニズムを明らかにしたことから、ミトコンドリアから細胞核への逆行性シグナルと標的遺伝子の解明が進みました。本研究成果により、ミトコンドリア機能不全で誘導される病態について、AREG等の分泌タンパク質を用いた早期診断・制御法の開発につながることが期待されます。
本研究成果は、文部科学省科学研究費助成事業、内藤記念振興財団研究助成、武田科学振興財団研究助成、熊本大学発生医学研究所高深度オミクス事業研究助成などの支援を受けて、英国の遺伝学専門誌「Nucleic Acids Research」オンライン版に英国(GMT)時間の令和4年9月12日【日本時間の9月13日】に掲載されました。
研究の内容及び成果
ミトコンドリアはエネルギー産生と物質代謝を担う細胞内小器官であり、独自の遺伝情報(mtDNA:ミトコンドリアDNA)を保持し、細胞核と密接に連絡し合っています【図1】。ゲノム(遺伝情報)を含む細胞核とエネルギー代謝を担うミトコンドリアの機能的な連携は、細胞および生物の恒常性の維持に不可欠です。ミトコンドリアの機能不全は、糖尿病・脂肪肝などのメタボリック症候群、脳・筋疾患、心疾患、がん、老化などに広く関わります【図2】。核とミトコンドリアのシグナリングの仕組みについては、核からミトコンドリアへの順行性シグナルの研究は進んでいますが、ミトコンドリアから核への逆行性シグナルには不明な点が多くあります。そこで、逆行性シグナルについて調べるために、ヒト肝臓細胞株を用いてミトコンドリアを3種類の方法(ミトコンドリア機能を調節する転写因子A(TFAM)のノックダウン、ミトコンドリア呼吸鎖の阻害薬、ミトコンドリアDNA欠損細胞)で機能不全にし、それらの細胞について網羅的な遺伝子発現解析(トランスクリプトーム)を実施しました【図3】。
その結果、ミトコンドリアの機能不全では、特定の転写因子を介して細胞核への逆行性シグナル伝達が活性化されることを見つけました。TFAMが消失すると、ミトコンドリアで産生されるエネルギー(ATP)の減少、すなわち、ミトコンドリア機能不全が生じました。一方、AREGおよびその他の分泌タンパク質の遺伝子発現は劇的に増加しました。このことについて、タンパク質の分泌経路を阻害する薬剤を用いると、細胞内にAREG が貯留することから、AREGなどの分泌タンパク質の遺伝子発現の増加によりAREGが産生・分泌されていることを確認しました。AREGなどの発現は、上記の3種類のミトコンドリア機能不全(ミトコンドリア・ストレス)のいずれの場合も同様に誘導されました。
高脂肪食などの栄養条件で肝障害を誘導したNASHモデルマウス(MCDマウス)は、肝臓でAREGなどの発現が増加することから、AREG増加がミトコンドリア機能不全の特徴のひとつであると考えました【図4】。また、ヒトのNAFLD肝臓検体のトランスクリプトーム解析でも、同様の傾向を確認しました。
次に、AREG発現誘導のメカニズムを明らかにするために、ミトコンドリア・ストレス下における遺伝子発現、エピゲノム(ヒストンタンパク質の修飾)※4および転写因子について詳しい解析を行いました【図5】。まずは、ヒトAREG遺伝子領域でミトコンドリア・ストレスに応答する新規のエンハンサー※5を探索し、転写活性型のヒストン修飾が増加する、3つのエンハンサーを同定しました。エンハンサーにはc-JUNおよびYAP1/TEADの結合配列が認められ、c-JUN又はYAP1の過剰発現によってAREGが高く発現することから、この2つの転写因子の経路でAREGが誘導されることが判明しました。なお、ミトコンドリア・ストレスがない状態では、クロマチンリモデリング因子BRG1 によってAREGの発現が抑制されていました。他方、ミトコンドリア・ストレスで逆に抑制されたエンハンサーには、肝臓細胞の代謝活動にはたらく転写因子HNF4の結合配列が認められました。つまり、ミトコンドリア・ストレス下では、ストレスに応答する転写因子c-JUN及びYAP1と肝臓特異的な転写因子HNF4のはたらき方を調節することで、細胞のはたらきがエネルギー代謝からストレス応答に変換されることを示しています。
今回の研究では、c-JUNとYAP1を介してAREG遺伝子のエンハンサーの活性化が起こり、ミトコンドリア・ストレスで誘導される分泌表現型を形成することを明らかにしました。このようなストレスを受けた肝臓細胞は、AREGなどのタンパク質分泌を促進して、自身や周りの細胞にはたらきかけるとともに、エネルギー代謝からストレス応答への転換が行われると考えられます。
本研究グループは、「エピジェネティクス」とよばれる学問の観点から、ゲノム上の遺伝子のはたらき方(ON/OFF)、健康と病気のメカニズムについて研究を進めています。これまでに、代謝調節、細胞老化、炎症応答に関わる修飾酵素を幅広く同定・解析・報告してきました。そのうち、細胞老化については、老化細胞が炎症性のタンパク質群を産生・分泌する「老化関連性分泌表現型(SASP)」に転換することが加齢に伴う慢性炎症に関わることが知られています【図6】。また、組織の線維化はコラーゲンの産生・分泌によることがわかっています。今回の研究成果は、ミトコンドリア機能不全の細胞がAREGなどの増殖関連のタンパク質を産生・分泌するという発見を契機として、「ミトコンドリア・ストレス関連性分泌表現型」の概念を提唱するものであり、ミトコンドリア機能不全の細胞病態を明らかにすることで、血液中のAREG測定など、病気の早期診断・制御法の開発に役立つことが期待できます。
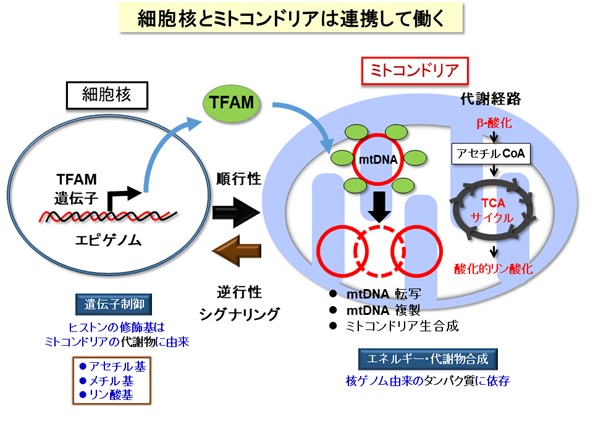
図1
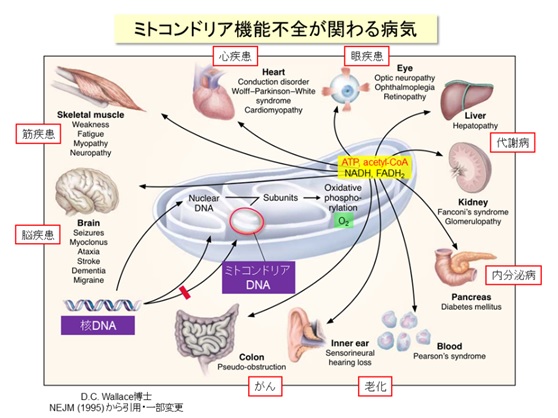
図2
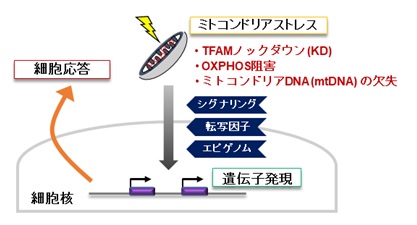
図3
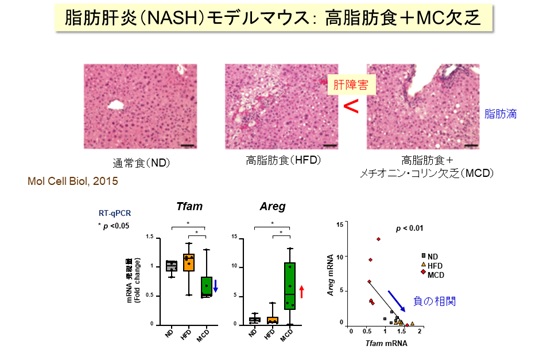
図4
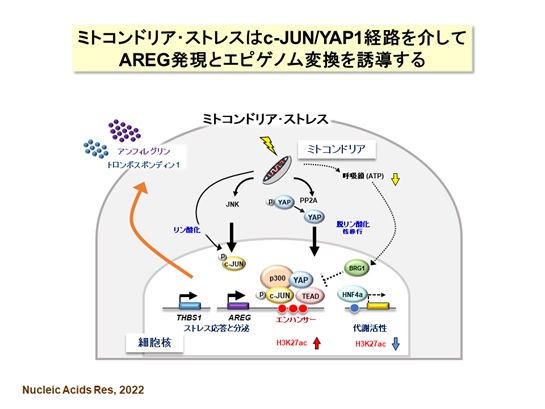
図5
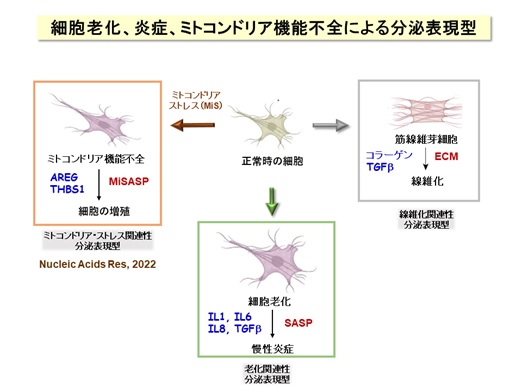
図6
用語解説
※1:AREG
細胞の増殖などを促進する分泌タンパク質(サイトカイン)。ミトコンドリア機能不全との関連性は知られていなかった。
※2:c-JUN, YAP1
c-JUNはストレス応答にはたらく転写因子。YAP1はTEADとともに環境の変化に応答する転写因子。両者の機能はリン酸化で制御されている。
※3:TFAM
Mitochondrial transcription factor A。核ゲノムにコードされてミトコンドリアDNAの転写と複製、ミトコンドリアの代謝調節を担う転写因子。
※4:エピゲノム(ヒストンタンパク質の修飾)
DNAの塩基配列を変えることなく、遺伝子のはたらきを決める仕組み。ゲノムDNAに巻き付くヒストンの末端に化学修飾(メチル化やアセチル化)が生じることで、遺伝子発現の活性化・不活性化をコントロールしている。
※5:エンハンサー
遺伝子の転写開始部分である「プロモーター」の活性を促進する塩基配列。遺伝子のプロモーターとエンハンサーには特定の転写因子が結合して、遺伝子の転写量を増加させることで遺伝子発現を増強する。

























科学技術振興機構(JST) プレス共同発表」
http://www.jst.go.jp/pr/announce/20150429/index.html
Nature Communications
Paper ‘FAD-dependent lysine-specific demethylase-1 regulates cellular energy expenditure’
Metabolism: How diet affects energy metabolism
DOI: 10.1038/ncomms1755
A novel mechanism for explaining how nutrients in the diet affect the energy metabolism in revealed in a paper published in Nature Communications this week. The study, which shows that a specific protein is a nutrient-sensitive regulator of genes involved energy metabolism, could potentially lead to new treatments of metabolic diseases.
Lysine-specific demetyhlase-1 (LSD1) is known to inhibit the activity of genes by chemically modifying DNA-packaging proteins, which makes it more difficult to read out genetic information. A team of Japanese researchers led by Mitsuyoshi Nakao discovered that LSD1 specifically regulates the activity of genes involved in energy and fatty-acid metabolism. They also found that the activity of genes controlled by LSD1 was markedly reduced in fat tissue of obese mice, but could be increased when mice were treated with drugs that inhibit LSD1. The results suggest that this mechanism is involved in the metabolic adaptation of cells in the body to nutrients in the diet.
The authors say that drugs that inhibit LSD1 could be useful for the treatment of metabolic disorders.
CONTACT
Mitsuyoshi Nakao ( Kumamoto University , Japan )
Tel: +81 96 373 6800; E-mail: mnakao@kumamoto-u.ac.jp