
Endocytosed dsRNAs induce lysosomal membrane permeabilization that allows cytosolic dsRNA translocation for Drosophila RNAi responses
Tsubasa Tanaka, Tamaki Yano, Shingo Usuki, Yoko Seo, Kento Mizuta, Maho Okaguchi, Maki Yamaguchi, Kazuko Hanyu-Nakamura, Noriko Toyama-Sorimachi, Katja Brückner, and Akira Nakamura
Nature Communications 15, 6993 (2024)
RNA干渉(RNAi)は、二本鎖RNA(dsRNA)の細胞質への侵入によって引き起こされる遺伝子サイレンシング機構です。RNAiを利用した核酸医薬がすでに治療薬として承認されています。細胞質において、dsRNAは21ヌクレオチド程度のsmall interference RNA(siRNA)にプロセシングされた後、RNAiエフェクターであるAgo2に取り込まれ、RNA-induced silencing complex(RISC)を形成することが知られています。RISCはsiRNAと相補的な配列を持ったRNAを切断することで、標的遺伝子をサイレンシングします。
多くの動物細胞では、細胞外のdsRNAをエンドサイトーシスにより細胞内に取り込み、RNAi応答に利用することができます。このような性質を利用した遺伝子ノックダウンスクリーニング(soaking RNAi)が盛んに行われてきました。しかし、エンドサイトーシスされた小胞内のdsRNAが、どのようにして小胞膜を越えて細胞質に移行するのかは明らかではありませんでした。唯一、線虫においては、SID-1と呼ばれるdsRNAのトランスポーターが細胞外のdsRNAを直接細胞質へと取り込み、全身性のRNAiを促進することが知られています。しかし、SID-1のホモログはショウジョウバエには存在せず、soaking RNAiスクリーニングが広く行われてきたショウジョウバエ培養細胞においては、まだ知られていない仕組みで 細胞外dsRNAが取り込まれていると予想されました。
今回、生殖発生分野の田中翼助教(2023年3月退職)らは、ショウジョウバエ培養細胞(S2細胞)において、エンドサイトーシスされたdsRNAがリソソーム膜透過(Lysosomal Membrane Permeabilization; LMP)を誘導して、細胞質へのdsRNA移行を可能にすることを明らかにしました。さらに、このようなdsRNAを介したLMPには、リソソームのCl–/H+アンチポーターであるClC-b/DmOstm1が必要であることを見出しました。clc-bまたはdmostm1をノックアウトしたS2細胞では、細胞外のdsRNAはエンドサイトーシスされ、正常にリソソームに到達することができます。しかし、小胞内のdsRNAは細胞質には移行することが出来ませんでした。一方、クロロキン等を用いてLMPを薬理学的に誘導すると、clc-bまたはdmostm1をノックアウトした細胞においても、培地中に添加したdsRNAによるRNAi反応が回復しました。さらに、clc-bあるいはdmostm1をノックアウトした変異体ハエ個体を作製した結果、これら変異体では、腹腔に顕微注射したdsRNAによるRNAi誘導は起きませんでしたが、ハエゲノムからdsRNAを発現させると、正常なRNAi反応が引き起こされました。また、これら変異体ハエでは、RNAウイルスの1つであるDrosophila C virus (DCV)に対する抗ウイルス免疫が不全となっていました。興味深いことに、DCVに感染すると、Ago2複合体にはDCVに対するsiRNAがclc-bあるいはdmostm1をノックアウトした変異体ハエでも検出されました。すなわち、リソソームのCl–/H+アンチポーターであるClC-b/DmOstm1は、DCV感染によるsiRNA産生自体ではなく、全身性の抗ウイルス免疫応答に必要であると考えられました。以上の研究から、エンドサイトーシスされ小胞内に蓄えられたdsRNAは、ClC-b/DmOstm1依存性のLMPを誘導する本質的な能力を持っており、ショウジョウバエ細胞におけるRNAi応答のための細胞質へのdsRNA移行を可能にしていることが明らかになりました。ウイルスRNAによって誘導される全身性の免疫応答に加えて、このdsRNA自体が持つ内在的な性質は、エンドサイトーシスを介した様々な細胞間コミュニケーションに寄与しているのかもしれません。
本研究成果は、2024年8月14日にNature Communications誌に掲載されました。また、本研究は、東北大学大学院薬学研究科・矢野環准教授、東京大学医科学研究所・反町典子教授、カリフォルニア大学サンフランシスコ校・Katja Brückner准教授(故人)との共同研究であり、本学薬学部の学部生4名(既卒)と発生医学研究所リエゾンラボ研究推進施設・臼杵慎吾 技術専門職員、生殖発生分野・羽生-中村賀津子 博士の協力のもと行われました。本研究は文部科学省/日本学術振興会 科学研究費助成事業、熊本大学 発生医学研究所 共同研究拠点、熊本大学 発生医学研究所 高深度オミクス医学研究拠点ネットワーク形成事業、熊本大学 発生医学研究所 4Dシステム発⽣・再⽣学イニシアティブ事業、三菱財団、武田科学振興財団からの支援を受けて実施されました。
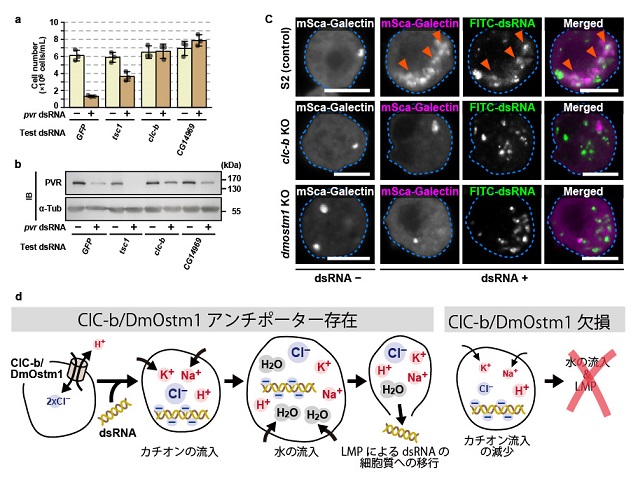
図の説明文
(a)Soaking RNAiスクリーニングの過程で、pvrノックダウンによる細胞死を抑制する因子として、clc-bとCG14969 (dmostm1)が同定された。(b)ウエスタン解析の結果、clc-bやCG14969をノックダウンするとPVRタンパク質が安定化されていることが判明した。すなわち、ClC-bとDmOstm1はsoaking RNAiに必要な因子であることがわかった。(c) 培地に添加したdsRNAはエンドサイトーシスされ小胞に取り込まれた後、LMPを誘導する。ここでは、LMPにより細胞質に露出した糖鎖をmScarlet(赤色蛍光タンパク質)-Galectin融合タンパク質で検出している。mSca-GalectinとFITC-dsRNAの二重陽性領域を矢頭で示す。clc-bあるいはdmostm1をノックアウトした細胞では、LMPが誘導されない。(d) Cl–/H+アンチポーターを介した小胞内dsRNAの細胞質移行のモデル。dsRNAはマイナスにチャージしており、小胞内の電荷を調整するためアニオンが流入すると予想される。その結果、小胞内の浸透圧が上昇し、水が流入することによりLMPが引き起こされて、dsRNAは細胞質に流出する。clc-b/dmostm1が欠失すると、このようなイオンの流れが停止すると予想され、LMPが起きなくなる。