
#Yoshimura S, #Shimada R, Kikuchi K, Kawagoe S, Abe H, Iisaka S, Fujimura S, Yasunaga K, Usuki S, Tani N, Ohba T, Kondoh E, Saio T, Araki K, ※Ishiguro K (# Equally contributed) : Atypical heat shock transcription factor HSF5 is critical for male meiotic prophase under non-stress conditions. Nature Communications 15, 3330 (2024)
DOI:doi.org/10.1038/s41467-024-47601-0
科学新聞 (PDF 547KB)
熊本大学発生医学研究所の石黒啓一郎教授、大学院医学教育部博士課程4年次の吉村早織大学院生及び島田龍輝助教のグループは、精子形成において減数分裂のプログラムの終結を制御する新しい遺伝子を発見しました。これまで、精子が作られる際に、減数分裂のプログラムに関わる遺伝子の発現を不活性化させる仕組みの詳細は明らかになっていなかったため、今後の無精子症や精子形成不全を示す不妊症の原因解明など生殖医療の進展につながる可能性があります。2024年4月29日に科学学術誌「Nature communications」から公表されました。
[研究の内容]
卵巣や精巣では減数分裂と呼ばれる特殊な細胞分裂が行われて、染色体の数が元の半分になることにより卵子や精子が作り出されます(図1)。卵子や精子形成過程で、減数分裂は雌雄で異なるコントロールが働くことがわかっています。特に精巣では減数分裂が完了すると、引き続いて直ちに精子形成に特徴的な大きな形態変化が生じます。この過程で精子の形態変化に向けて、それまで減数分裂を実行するために活発であった多くの遺伝子の発現が不活性化されます。しかしながら、精子形成に向けた遺伝子の活性化と減数分裂を終結に向かわせるメカニズムの詳細は不明であり、男性の不妊症などの生殖医療とも直結する重要な問題でありながら、世界的にも長年解明されない課題でした。今回、石黒教授のグループは、減数分裂の仕組みには、男性(精巣)と女性(卵巣)との間で異なる調節があること、さらに精巣に特異的な減数分裂の進行調節と精子形成の活性化の両方に関わる重要な遺伝子を特定しました。
(背景)
卵子や精子形成過程のいずれにおいても、おおむね減数分裂は同じ仕組みで起きますが、雌雄でコントロールのされ方が異なることがわかっています。特に精巣では減数分裂の完了後に精子形成に特徴的な大きな形態変化が生じます。この精子形成に向けて、減数分裂を実行するために活発であった多くの遺伝子の発現が不活性化されます。しかしながら、精子形成に向けた遺伝子の活性化と減数分裂を終結に向かわせる遺伝子発現制御のメカニズムの詳細は不明であり、世界的にも長年解明されない課題でした。
[成果]
今回の研究成果は本研究グループが2020年に公表した減数分裂のスイッチを入れるMEIOSINの発見(図1)に続く続報で、MEIOSINの指令下で働くことが予想される機能未解明の遺伝子の働きの一端を明らかにしたものです。その一つとして見つかったHSF5は、Heat Shock Factor(熱ショック因子)と分類されるタンパク質の一つで、精巣で特異的に発現を示します(図2)。他の類似のHSF1 HSF2 HSF3 HSF4は熱ストレスに応答して働くことが知られていたのですが、HSF5の機能は不明でした。本来精巣は熱ストレスに弱い組織であることがわかっており、通常は男性(オス)の睾丸はぶら下がって体内37度より3-4低い温度に保たれています。本研究は、HSF5が熱ショック応答に働くのか?あるいは全く未知の別の機能があるのか?を問うのが当初の目的でした。
まずゲノム編集によりマウスのHSF5遺伝子の働きをなくすと、オスの生殖細胞がいったんは減数分裂を始めるものの、途中で死滅して精子がまったく作られず不妊となることが判明しました(図3)。次に、シングルセルRNA-seqと呼ばれる手法を駆使して、HSF5欠損マウスの精巣を詳細に解析したところ、HSF5が減数分裂の中盤以降の制御に必須の働きをしており、精子形成の活性化に関わる働きがあることを解明しました(図3)。さらに、ChIP-seq法、Cut&Tag法やゲルシフト法などを駆使したゲノム結合解析の手法を用いて、HSF5が減数分裂の中盤に出現してDNAと直接結合する活性があること、さらに精子形成活性化に役割を果たす多くの遺伝子のプロモーター領域に結合し、減数分裂のプログラムを完了に向かわせると同時に精子形成の指令に働くことを明らかにしました。
HSF5はその名の由来でHeat Shock Factor(熱ショック因子)と分類されるタンパク質の一つですが、従来知られていた熱ショック因子とはまったく異なるメカニズムによりDNAと直接結合する活性を示すことや熱ストレス応答ではなく生殖細胞の発生を制御する働きがあることを明らかにした点においても、学術的には驚きの発見でした。 HSF5は減数分裂の終了プロセスに必須の働きをしており、精子の形成に関わる重要な遺伝子であることから、今後の不妊症の病態解明など生殖医療の進展につながる可能性があります。
本研究は熊本大学生命資源研究・支援センター、徳島大学先端酵素研との共同で実施したものです。また、本研究は以下の支援を受けて行われました。
日本医療研究開発機構(AMED)
・革新的先端研究開発支援事業(PRIME)「健康・医療の向上に向けた早期ライフステージにおける生命現象の解明」研究開発領域「疾患モデル動物を用いた生殖可能ライフスパンに関する研究開発」(JP21m6310021)
日本学術振興会(JSPS)・文部科学省科学研究費
・基盤研究(A)23H00379 「減数分裂と体細胞分裂との本質的な違いを決定するメカニズムの解明」
・新学術領域研究19H05743「減数分裂における高次クロマチン構造の確立機構の解明」
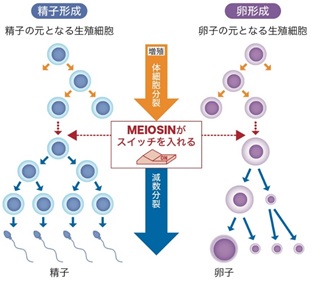
図1 体細胞分裂から減数分裂に切り替わるメカニズム
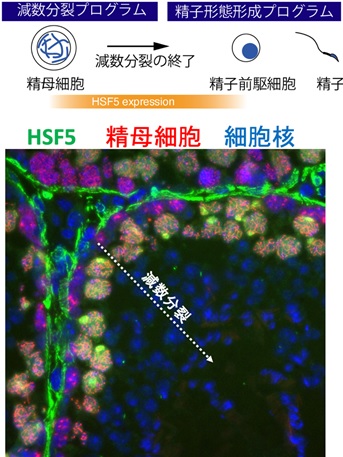
図2 HSF5は精巣の中で減数分裂を進行中の精母細胞で発現する
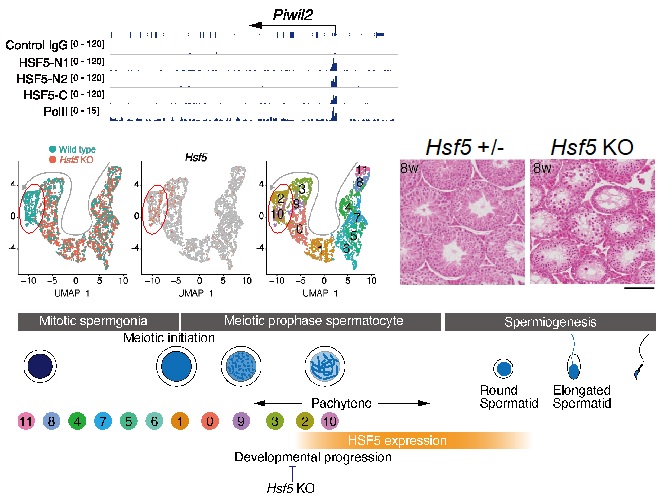
図3 HSF5遺伝子の欠損マウスの解析