
論文名:STRA8–RB interaction is required for timely entry of meiosis in mouse female germ cells
著者:Ryuki Shimada, Yuzuru Kato, Naoki Takeda, Sayoko Fujimura, Kei-ichiro Yasunaga, Shingo Usuki, Hitoshi Niwa, Kimi Araki, and Kei-ichiro Ishiguro
掲載誌:Nature Communications 14, 6443 (2023)
DOI:10.1038/s41467-023-42259-6
西日本新聞(社会面)
共同通信社
熊本大学発生医学研究所の石黒啓一郎教授及び島田龍輝助教のグループは、卵子の形成に必要な減数分裂をコントロールする仕組み、癌抑制タンパク質の働きを解除することが必須であることを発見しました。科学学術誌「Nature communications」から公表されました。
[研究の内容]
全身の組織・器官では、通常「体細胞分裂」と呼ばれる細胞分裂によって細胞の増殖が行われます。一方、卵巣や精巣では「減数分裂」と呼ばれる特殊な細胞分裂が行われて、染色体の数が元の半分になることにより卵子や精子が作り出されます。男性の場合、精巣では思春期以降になるとほぼ生涯にわたって減数分裂が繰り返されて精子が産生されます。それに対して、女性の場合は胎児の時期の、ごく限られた一時期に卵巣の中で減数分裂が開始されます。胎児の時期に減数分裂に入った卵子は、排卵が起こるまでいったん長期の休眠状態に入ります(図1)。
したがって、男性とは違って、女性の場合、生殖細胞が減数分裂に入って卵子になるチャンスは、生まれるずっと前、この胎児期の時期しかありません。女性の卵巣では胎児期の限定された時期に減数分裂に入ることができた生殖細胞によって、生涯にわたって必要とされる生殖可能な卵子の数が決まることになります。しかしながら、胎児のある一時期に限って減数分裂に入る女性に特有のメカニズムは全く分かっていませんでした。今回、減数分裂の開始の仕組みには、男性(精巣)と女性(卵巣)との間で異なる調節があること、そして卵巣に特化した減数分裂の開始の様式に癌抑制タンパク質RBの働きが関与していることを見つけました。
石黒教授らの研究グループは、これまでの研究で減数分裂のスイッチを入れる遺伝子MEIOSINを発見し、それによって数百種類におよぶ精子・卵子の形成に関わる遺伝子が一斉に働くことや、MEIOSINの働きによって体細胞分裂から減数分裂に切り替わるメカニズムを明らかにしました(Ishiguro et al., Dev Cell 2020)。
とくに女性の場合、生殖細胞の体細胞分裂から減数分裂への分裂様式の切り替えは出生前の母胎の中にいる間のごく限られた時期で起こる現象であるため、そのメカニズムの詳細は不明であり、研究が進んでいない背景がありました。また女性の減数分裂のコントロールは、原発性卵巣不全(早発性閉経)など不妊症などの問題とも直結する重要な問題でありながら、世界的にも長年解明されない課題でした。
[成果]
石黒教授らの研究グループは、卵子を作り出す過程で減数分裂がどのタイミングでどのように起きているのかを詳細に調べるために遺伝子改変マウスを作製して、卵巣内に含まれるタンパク質の解析や様々な遺伝子の働きを調べる研究を行いました。質量分析法を駆使した解析により、STRA8とよばれるタンパク質が、癌抑制タンパク質・レチノブラストーマタンパク質(RB)と結合していることを見つけました。本来、このレチノブラストーマタンパク質(RB)は、細胞増殖が暴走し過ぎないように適度にDNA合成を抑えるように働く、いわば増殖のブレーキのような役割があることが既に知られていました。また、同グループの以前の研究で、STRA8タンパク質が減数分裂の“スイッチ”として働く「MEIOSIN」(マイオーシン)と結合していることが分かっていましたが、なぜRBと結合しているのかは謎でした。
そこで、ゲノム編集によりマウスのSTRA8遺伝子に人為的に変異を導入して、STRA8とRBとの結合を解消させると、早期に卵子が枯渇して不妊となることが判明しました。さらに、シングルセルRNA-seq法という少数の細胞の遺伝子発現を検出する解析手法を用いて、様々な遺伝子の挙動を調べたところ、メスの卵巣において減数分裂が胎児期の起こるべきタイミングの適切な時期に起こらなくなることが分かりました。本来、減数分裂を引き起こすには、前もってDNA合成のプロセスを経てゲノム倍加をさせておく必要があります。しかし、このSTRA8タンパク質がRBとの結合できなくなると、マウスのメス生殖細胞内ではRBが強く働きつづけるため、然るべきタイミングでゲノム倍加のDNA合成のプロセスが正常に機能していないこと、それに伴ってさらにMEIOSINの活性化がうまくいかなくなることが分かりました。その結果、予定通りの適切なタイミングで減数分裂が開始されなくなります(図2)。
ほとんどの卵子が出生前後の早期に自滅(アポトーシス)遺伝子が誘導されて死滅してしまい、卵巣の中で卵子の貯蔵がうまくいかなくなることを突き止めました(図3)。これら一連の研究から、胎児期の卵巣で、減数分裂を発動させるには、STRA8タンパク質がRBの働きを一過的に緩めて、DNA合成を促進させてやることが、卵子の形成に関わる重要なメカニズムであることを解明しました。
本研究は熊本大学生命資源研究・支援センター、国立遺伝学研究所との共同で実施したものです。また、本研究は以下の支援を受けて行われました。
日本医療研究開発機構(AMED)
・革新的先端研究開発支援事業(PRIME)「健康・医療の向上に向けた早期ライフステージにおける生命現象の解明」研究開発領域「疾患モデル動物を用いた生殖可能ライフスパンに関する研究開発」(JP21m6310021)
日本学術振興会(JSPS)・文部科学省科学研究費
・基盤研究(A)23H00379 「減数分裂と体細胞分裂との本質的な違いを決定するメカニズムの解明」
・新学術領域研究19H05743「減数分裂における高次クロマチン構造の確立機構の解明」
・挑戦的研究(萌芽) 22K19315「メス生殖細胞に特異的な減数分裂制御機構の解明」
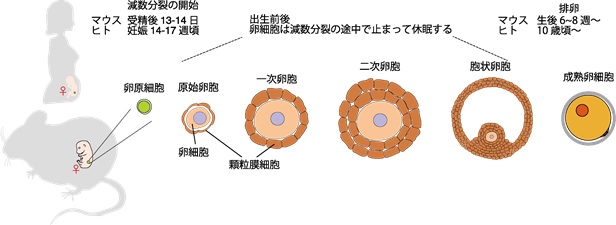
図1 卵子の減数分裂開始、休眠、成熟過程
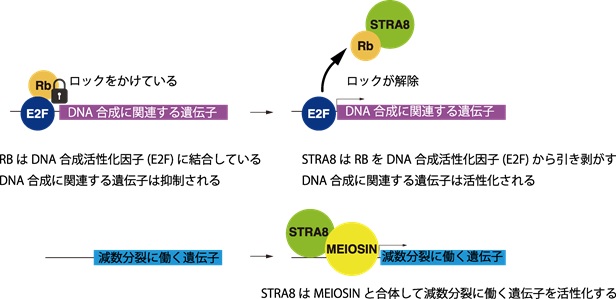
図2 STRA8がRBによるDNA合成の抑制を一時解除する仕組み
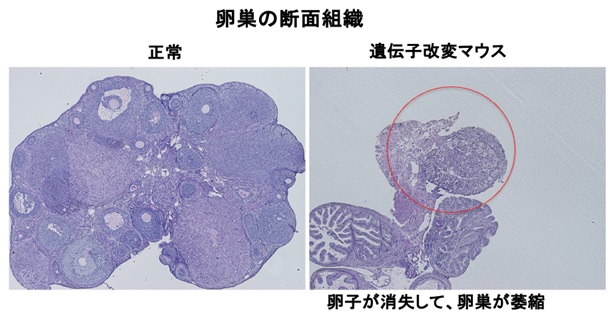
図3 遺伝子改変マウスでは卵子が早期に枯渇する