
Mitochondrial stress induces AREG expression and epigenomic remodeling through c-JUN and YAP-mediated enhancer activation
Yuko Hino, Katsuya Nagaoka, Shinya Oki, Kan Etoh, Shinjiro Hino*, and Mitsuyoshi Nakao*
Nucleic Acids Research
https://doi.org/10.1093/nar/gkac735
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkac735/6696363?searchresult=1
ポイント
概要説明
熊本大学発生医学研究所細胞医学分野の中尾光善教授、日野裕子技術支援者、日野信次朗准教授らは、網羅的な遺伝子発現解析技術を用いて、ミトコンドリア機能不全に陥った肝臓細胞はc-JUNとYAP1により細胞内シグナリングを活性化して、AREGなどのタンパク質を産生・分泌することを初めて発見しました。c-JUNとYAP1は細胞内外の環境の変化に応答して標的遺伝子のはたらきを調節する転写因子です。また、AREGは細胞の増殖などを調節する分泌タンパク質です。本研究により、ミトコンドリアにストレスを受けた細胞は、特定のタンパク質を産生・分泌する状態(分泌表現型)に転換して、周りの細胞にメッセージを出すことが分かりました。
一方、特に近年増加している「非アルコール性脂肪肝炎」(NASH:ナッシュ)や「非アルコール性肝疾患」(NAFLD:ナッフルド)の発症には、肝臓細胞のミトコンドリア機能不全が密接に関わることが知られています。それらのモデルマウスおよびヒトの肝臓検体を調べたところ、ミトコンドリア機能を調節する転写因子TFAM※3の発現が低下しているとともに、AREGの遺伝子発現が増加していることを確認しました。
今回、ミトコンドリア機能不全に陥った肝臓細胞が分泌表現型に換わるメカニズムを明らかにしたことから、ミトコンドリアから細胞核への逆行性シグナルと標的遺伝子の解明が進みました。本研究成果により、ミトコンドリア機能不全で誘導される病態について、AREG等の分泌タンパク質を用いた早期診断・制御法の開発につながることが期待されます。
本研究成果は、文部科学省科学研究費助成事業、内藤記念振興財団研究助成、武田科学振興財団研究助成、熊本大学発生医学研究所高深度オミクス事業研究助成などの支援を受けて、英国の遺伝学専門誌「Nucleic Acids Research」オンライン版に英国(GMT)時間の令和4年9月12日【日本時間の9月13日】に掲載されました。
研究の内容及び成果
ミトコンドリアはエネルギー産生と物質代謝を担う細胞内小器官であり、独自の遺伝情報(mtDNA:ミトコンドリアDNA)を保持し、細胞核と密接に連絡し合っています【図1】。ゲノム(遺伝情報)を含む細胞核とエネルギー代謝を担うミトコンドリアの機能的な連携は、細胞および生物の恒常性の維持に不可欠です。ミトコンドリアの機能不全は、糖尿病・脂肪肝などのメタボリック症候群、脳・筋疾患、心疾患、がん、老化などに広く関わります【図2】。核とミトコンドリアのシグナリングの仕組みについては、核からミトコンドリアへの順行性シグナルの研究は進んでいますが、ミトコンドリアから核への逆行性シグナルには不明な点が多くあります。そこで、逆行性シグナルについて調べるために、ヒト肝臓細胞株を用いてミトコンドリアを3種類の方法(ミトコンドリア機能を調節する転写因子A(TFAM)のノックダウン、ミトコンドリア呼吸鎖の阻害薬、ミトコンドリアDNA欠損細胞)で機能不全にし、それらの細胞について網羅的な遺伝子発現解析(トランスクリプトーム)を実施しました【図3】。
その結果、ミトコンドリアの機能不全では、特定の転写因子を介して細胞核への逆行性シグナル伝達が活性化されることを見つけました。TFAMが消失すると、ミトコンドリアで産生されるエネルギー(ATP)の減少、すなわち、ミトコンドリア機能不全が生じました。一方、AREGおよびその他の分泌タンパク質の遺伝子発現は劇的に増加しました。このことについて、タンパク質の分泌経路を阻害する薬剤を用いると、細胞内にAREG が貯留することから、AREGなどの分泌タンパク質の遺伝子発現の増加によりAREGが産生・分泌されていることを確認しました。AREGなどの発現は、上記の3種類のミトコンドリア機能不全(ミトコンドリア・ストレス)のいずれの場合も同様に誘導されました。
高脂肪食などの栄養条件で肝障害を誘導したNASHモデルマウス(MCDマウス)は、肝臓でAREGなどの発現が増加することから、AREG増加がミトコンドリア機能不全の特徴のひとつであると考えました【図4】。また、ヒトのNAFLD肝臓検体のトランスクリプトーム解析でも、同様の傾向を確認しました。
次に、AREG発現誘導のメカニズムを明らかにするために、ミトコンドリア・ストレス下における遺伝子発現、エピゲノム(ヒストンタンパク質の修飾)※4および転写因子について詳しい解析を行いました【図5】。まずは、ヒトAREG遺伝子領域でミトコンドリア・ストレスに応答する新規のエンハンサー※5を探索し、転写活性型のヒストン修飾が増加する、3つのエンハンサーを同定しました。エンハンサーにはc-JUNおよびYAP1/TEADの結合配列が認められ、c-JUN又はYAP1の過剰発現によってAREGが高く発現することから、この2つの転写因子の経路でAREGが誘導されることが判明しました。なお、ミトコンドリア・ストレスがない状態では、クロマチンリモデリング因子BRG1 によってAREGの発現が抑制されていました。他方、ミトコンドリア・ストレスで逆に抑制されたエンハンサーには、肝臓細胞の代謝活動にはたらく転写因子HNF4の結合配列が認められました。つまり、ミトコンドリア・ストレス下では、ストレスに応答する転写因子c-JUN及びYAP1と肝臓特異的な転写因子HNF4のはたらき方を調節することで、細胞のはたらきがエネルギー代謝からストレス応答に変換されることを示しています。
今回の研究では、c-JUNとYAP1を介してAREG遺伝子のエンハンサーの活性化が起こり、ミトコンドリア・ストレスで誘導される分泌表現型を形成することを明らかにしました。このようなストレスを受けた肝臓細胞は、AREGなどのタンパク質分泌を促進して、自身や周りの細胞にはたらきかけるとともに、エネルギー代謝からストレス応答への転換が行われると考えられます。
本研究グループは、「エピジェネティクス」とよばれる学問の観点から、ゲノム上の遺伝子のはたらき方(ON/OFF)、健康と病気のメカニズムについて研究を進めています。これまでに、代謝調節、細胞老化、炎症応答に関わる修飾酵素を幅広く同定・解析・報告してきました。そのうち、細胞老化については、老化細胞が炎症性のタンパク質群を産生・分泌する「老化関連性分泌表現型(SASP)」に転換することが加齢に伴う慢性炎症に関わることが知られています【図6】。また、組織の線維化はコラーゲンの産生・分泌によることがわかっています。今回の研究成果は、ミトコンドリア機能不全の細胞がAREGなどの増殖関連のタンパク質を産生・分泌するという発見を契機として、「ミトコンドリア・ストレス関連性分泌表現型」の概念を提唱するものであり、ミトコンドリア機能不全の細胞病態を明らかにすることで、血液中のAREG測定など、病気の早期診断・制御法の開発に役立つことが期待できます。
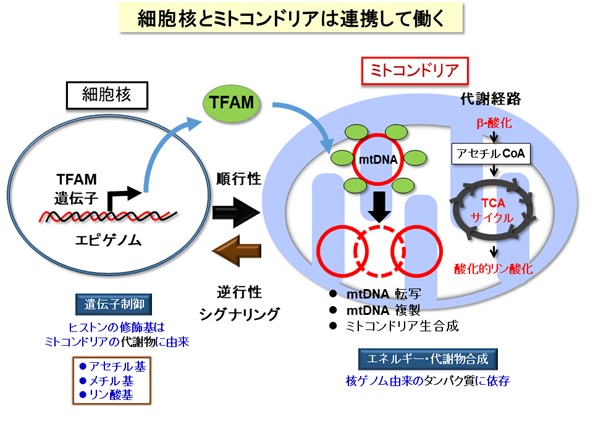
図1
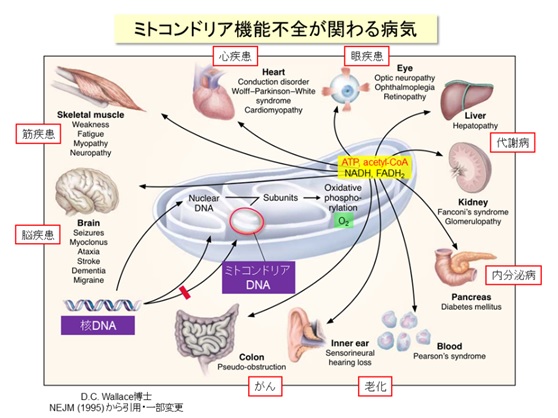
図2
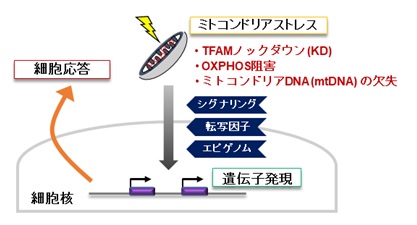
図3
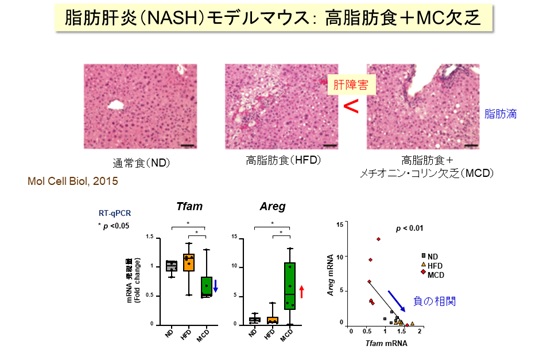
図4
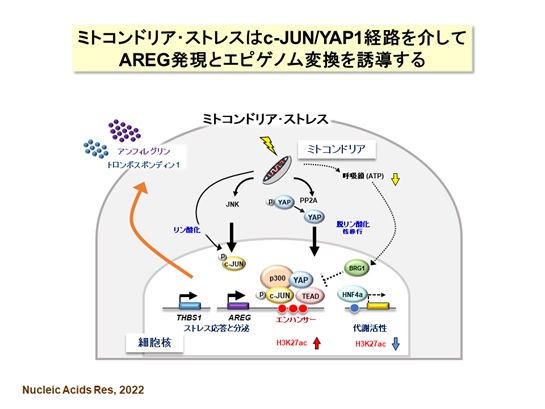
図5
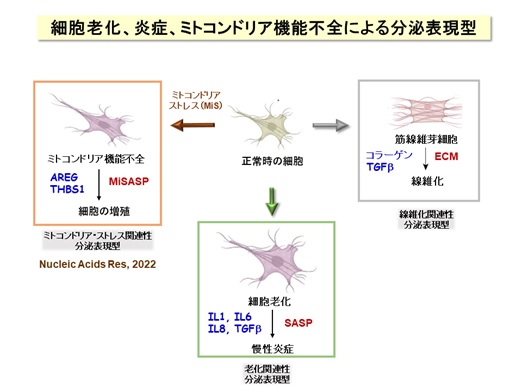
図6
用語解説
※1:AREG
細胞の増殖などを促進する分泌タンパク質(サイトカイン)。ミトコンドリア機能不全との関連性は知られていなかった。
※2:c-JUN, YAP1
c-JUNはストレス応答にはたらく転写因子。YAP1はTEADとともに環境の変化に応答する転写因子。両者の機能はリン酸化で制御されている。
※3:TFAM
Mitochondrial transcription factor A。核ゲノムにコードされてミトコンドリアDNAの転写と複製、ミトコンドリアの代謝調節を担う転写因子。
※4:エピゲノム(ヒストンタンパク質の修飾)
DNAの塩基配列を変えることなく、遺伝子のはたらきを決める仕組み。ゲノムDNAに巻き付くヒストンの末端に化学修飾(メチル化やアセチル化)が生じることで、遺伝子発現の活性化・不活性化をコントロールしている。
※5:エンハンサー
遺伝子の転写開始部分である「プロモーター」の活性を促進する塩基配列。遺伝子のプロモーターとエンハンサーには特定の転写因子が結合して、遺伝子の転写量を増加させることで遺伝子発現を増強する。