Tanno N, Kuninaka S, Fujimura S, Takemoto K, Okamura K, Takeda N, Araki K, Araki M, Saya H, Ishiguro K* : Phosphorylation of the Anaphase Promoting Complex activator FZR1/CDH1 is required for Meiosis II entry in mouse male germ cell. Scientific Reports 10 10094 (2020)
卵巣や精巣では「減数分裂」と呼ばれる特殊な細胞分裂が行われて卵子や精子が作り出されます。減数分裂は2回の連続した細胞分裂により染色体の数が元の半分に減らして母方・父方の遺伝情報だけを持つ卵子や精子が作り出されます。体細胞分裂で見られる一般的な細胞周期はG1 → S → G2 → M → G1 の繰り返しですが、減数分裂を細胞周期になぞらえるとG1 → S → G2 → M1回目 → (S期なし)→ M2回目 と 第一分裂と第二分裂の間には間期やS期に相当する明確な時期がありません。減数分裂では言わば細胞周期の変形版が働いていると推定されますが、その仕組みについてはあまりよく研究がされていない背景があります。
体細胞分裂の細胞周期の各ステップがCDKの活性によって制御されていることは近年の膨大な研究によりよく知られています。またAnaphase promoting complex/Cyclosome (APC/C)は体細胞分裂の細胞周期を不可逆的に駆動するE3ユビキチンリガーゼとして知られています。FZR1(CDH1)はAPC/Cに直接結合して基質選択性を与える活性化因子として働き、細胞周期進行に関連する様々なタンパク質(サイクリン、DNA複製装置タンパク質、染色体分配装置など)を分解に導きます。とりわけG1期を通してAPC/CはFZR1(CDH1)との結合により活性化してS期移行のための準備を整えるのに重要な役割を担うことがわかっています。また体細胞分裂の細胞周期において、FZR1(CDH1)はCDKによるリン酸化によってAPC/Cとの結合および解離が制御されることが知られていました。すなわちFZR1(CDH1)はG2/M期におけるCDK活性の亢進によってリン酸化を受けるとAPC/Cから解離し、CDK活性が低レベルに保たれるG1期ではAPC/Cと結合してその活性化を制御することがわかっていました。CDKによるFZR1(CDH1)リン酸化が体細胞分裂の細胞周期の制御に極めて重要な役割を果たすことが1990年代後半から2000年代中盤にかけての培養細胞レベルの先行研究から知られていましたが、哺乳類生体内における役割については研究がされていませんでした。
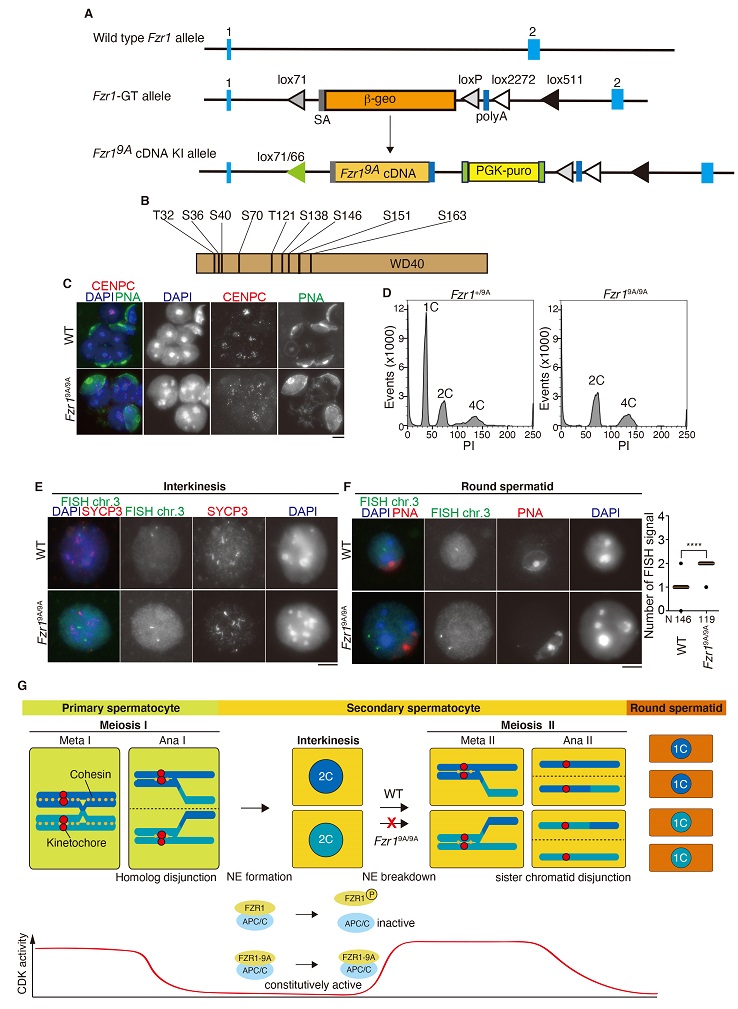
染色体制御分野・大学院生・丹野修宏(慶應義塾大学大学院 佐谷秀行教授の研究室より派遣)は個体の組織・器官レベルでのFZR1(CDH1)リン酸化によるAPC/Cの活性制御の意義について検討を行いました。まずCARD・荒木正健准教授、荒木喜美教授らの開発した可変型遺伝子トラップ法を駆使してFZR1(CDH1)内の9箇所のリン酸化部位にアラニン置換を導入し、非リン酸化型を模倣した変異FZR1-9Aを発現するノックインマウス (Fzr19A/9A KI)を作製しました(図A, B)。この研究の開始当初、Fzr19A/9A KIマウスの体細胞分裂において非リン酸化型FZR1-9AがAPC/Cを恒常的に活性化すること、さらにこれによって体細胞分裂の細胞周期が攪乱されることを予想していました。しかしながら、意外なことにFzr19A/9A KIマウスは体細胞組織における体細胞分裂に顕著な異常を示さず、精子形成に異常をきたして雄性不妊を示すことが判明しました。非リン酸化型FZR1を発現するマウス精巣では第一分裂は正常に完了するものの最終的には精子前駆細胞と酷似したサイズの大きい細胞の蓄積を伴って停止するという、これまでの先行研究では前例のない表現型を示すことがわかりました(図C)。そこで、この巨大な精子前駆細胞と酷似した細胞の正体を突き止めるために、以下のキーとなる実験により検証を行いました。
通常の野生型の精巣では円形精子前駆細胞に相当するDNA content 1Cの細胞集団が確認されるのに対して、Fzr19A/9A KIマウスでは半数体1Cに相当する細胞集団が観察されないことを実験的に示しました(図D)。したがってFzr19A/9A KIマウスで蓄積する巨大な円形精子前駆細胞は減数第二分裂を正常に経ていない可能性が示唆されました。さらにimmuno-FISH法を用いて減数第二分裂前後における染色体分配の様式について検討を行いました。その結果、Fzr19A/9A KIマウスの巨大円形精子前駆細胞では姉妹染色分体の不分離が観察され、減数第二分裂への進行が起きていないことが明らかとなりました(図E, F)。
興味深いことに、Fzr19A/9A KIマウス雌には顕著な生殖能の異常は観察されず、表現型に性差があることがわかりました。雄の減数分裂では第一分裂と第二分裂との間に核膜再形成と染色体脱凝縮を伴う一過的な間期(interkinesis期)があるのに対して、雌にはそれに対応する時期が存在しません。おそらくCDKの高活性レベルが回復する第二分裂に先駆けて、Fzr19A/9A KIマウスでは恒常的に活性化されたAPC/Cが核膜崩壊と染色体再凝縮に必要とされるタンパク質を過剰に分解するために第二分裂への移行が障害されることが示唆されました。したがって雄の減数第二分裂への進行にはCDKによるFZR1リン酸化制御とそれに伴うFZR1のAPC/Cからの脱離が必要であると結論されました(図G)。
第一分裂と第二分裂の間にはなぜS期がないのか?というのは未だ解かれていない生物学的大問題の一つです。本研究はCDKとAPC/Cという2つのキー因子が減数第二分裂への移行に関与するということを初めて示した内容ですが、この挑戦的課題への前進となることが期待されます。