
Koji Kikuchi*, Yasuhisa Sakamoto, Akiyoshi Uezu, Hideyuki Yamamoto, Kei-ichiro Ishiguro, Kenji Shimamura, Taro Saito, Shin-ichi Hisanaga, and Hiroyuki Nakanishi (*, corresponding author)
Map7D2 and Map7D1 facilitate microtubule stabilization through distinct mechanisms in neuronal cells
Life Sci. Alliance
DOI: 10.26508/lsa.202201390
概要
熊本大学大学院生命科学研究部・細胞情報薬理学講座の菊池浩二講師、同大学発生医学研究所・染色体制御分野の石黒啓一郎教授、同研究所・脳発生分野の嶋村健児教授、東京都立大学理学研究科・神経分子機能研究室の久永真市客員教授らは、神経細胞の形態や運動を調節する新しい制御システムの解明に成功しました。
本研究グループは微小管結合タンパク質のひとつであるMap7D2が微小管に結合して直接的に安定化することにより神経系の培養細胞の形態や運動を調節することを見出しました。また、Map7D2と同じファミリーに属するMap7D1がMap7D2とは異なるメカニズムによって微小管を安定化して形態や運動を調節したことから、ファミリー間で機能のダイバーシティが存在することを見出しました。さらに、Map7D2は脳や精巣で特異的に発現し、特に、脳では嗅神経細胞の軸索が集積する嗅球・糸球体層で発現が高かったことから、生体内においても神経細胞の微小管の安定化を調節して神経細胞の形態を調節する可能性を見出しました。本研究の成果は、国際学術誌「Life Science Alliance」で令和4年4月25日(月)アメリカ東部標準時間午前9時(日本時間:4月25日(月)23時)にオンライン公開されます。
※本研究は、文部科学省科学研究費補助金(基盤研究(C))、公益財団法人武田科学振興財団、公益財団法人日本二分脊椎・水頭症研究振興財団、公益財団法人アステラス病態代謝研究会、公益財団法人持田記念医学薬学振興財団、公益財団法人上原記念生命科学財団の支援を受けました。
説明
細胞が機能する時に、細胞は機能の発現に適した形態をとる必要があります。そして、細胞の形態は細胞骨格によって制御されることが知られています。細胞骨格のひとつである微小管はそれを構成するタンパク質チューブリンの結合や分離(重合・脱重合)によりダイナミックな伸長と短縮を繰り返す性質を持ちます(図1)。こうした微小管のダイナミクスは細胞運動などの形態の変化を伴う細胞機能の発現に必須です。これまでに微小管ダイナミクスに関与する様々な分子が同定されてきましたが、その制御メカニズムは細胞機能に応じて多様であり、依然として不明な点が多く残されています。
本研究グループは、様々な細胞機能における微小管ダイナミクスの制御メカニズムの理解を目指して研究を進めています(EMBO J., 2010.; J. Cell Sci., 2012.; EMBO Rep., 2018.)。これまでの研究経過から、MAP7ファミリーと呼ばれる微小管結合タンパク質のファミリーに着目し、本研究ではまず始めにそのファミリーに属するMap7D2の機能解析を実施しました。その結果、Map7D2が微小管に結合して直接的に安定化することにより神経系の培養細胞の形態や運動を調節することを明らかにしました。次に、Map7D2と同様にMAP7ファミリーに属するMap7D1の機能解析を実施し、Map7D1が微小管の安定化に関わるチューブリンアセチル化の維持を介して微小管を安定化して形態や運動を調節することを明らかにしました。従って、Map7D2とMap7D1はMAP7ファミリーという同じファミリーに属するにも関わらず、異なるメカニズムによって微小管を安定化して形態や運動を調節したことから、ファミリー間で機能のダイバーシティが存在することを明らかにしました(図2)。さらに、Map7D2については、げっ歯類における臓器ごとの発現分布を解析しました。Map7D2は脳や精巣で特異的に発現し、特に、脳では嗅神経細胞の軸索が集積する嗅球・糸球体層で発現が高く、精巣の精細管にあるセルトリ細胞で発現が高いことを明らかにしました(図3)。発現分布の解析結果から、生体内においてもMap7D2が神経細胞の微小管の安定化を調節して神経細胞の形態を調節する可能性が示唆されました。
本研究成果により、神経細胞の形態や運動を調節する新しい制御システムが解明されましたが、では、生体内においても同様のメカニズムが存在するのでしょうか?本研究グループでは、これまでの基礎研究の成果に基づき、新たにマウスモデルの研究を立ち上げ、その問いを明らかにすべく、研究を継続しております。
図1 微小管ダイナミクスの概要
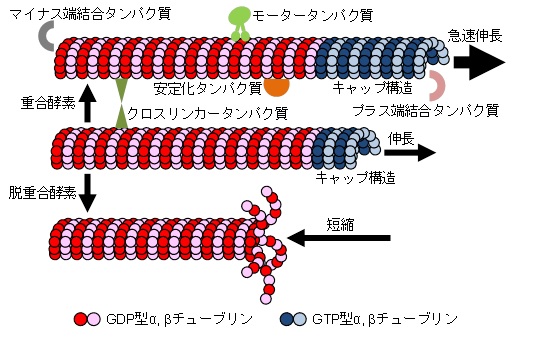
細胞骨格のひとつである微小管は微小管を構成するチューブリンの重合・脱重合によりダイナミックな伸長と短縮を繰り返す性質を持ちます。こうした微小管のダイナミクスは様々な微小管結合タンパク質により制御されることが知られています。しかし、その制御メカニズムは細胞機能に応じて多様であり、依然として不明な点が多く残されています。
図2 Map7D2とMap7D1による微小管安定化の制御メカニズム
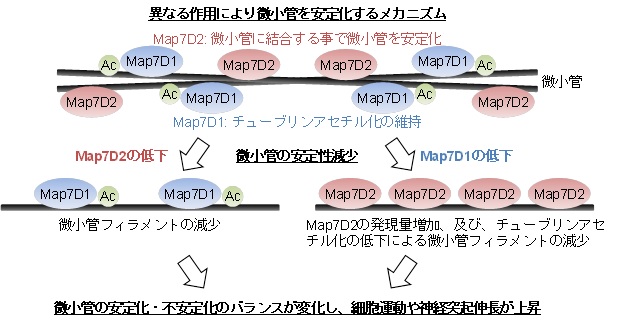
MAP7ファミリーと呼ばれる微小管結合タンパク質のファミリーに属するMap7D2とMap7D1が異なる作用により微小管を安定化するメカニズムを発見しました。Map7D2は微小管に結合して直接的に安定化することにより神経系の培養細胞の形態や運動を調節しました。一方で、Map7D1は微小管の安定化に関わるチューブリンアセチル化の維持を介して微小管を安定化して形態や運動を調節しました。従って、Map7D2とMap7D1はMAP7ファミリーという同じファミリーに属するにも関わらず、異なるメカニズムにより微小管を安定化して形態や運動を調節したことから、ファミリー間で機能のダイバーシティが存在することを明らかにしました。
図3 Map7D2の脳、及び、精巣における発現パターン
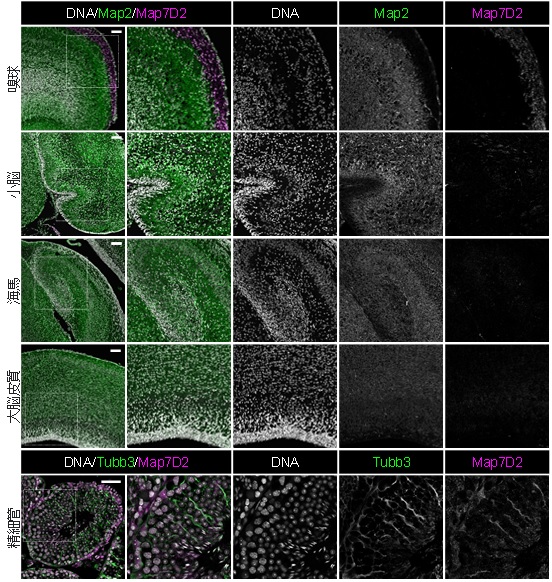
Map7D2は脳や精巣で特異的に発現し、特に、脳では嗅神経細胞の軸索が集積する嗅球・糸球体層で発現が高く、精巣の精細管にあるセルトリ細胞で発現が高いことがわかりました。発現分布より、生体内においてもMap7D2が神経細胞の微小管の安定化を調節して神経細胞の形態を調節する可能性が示唆されました。