

形態制御分野は2020年10月に発足しました。当分野では、体の器官や組織の「形がどのように作られて維持されているのか」、その分子メカニズムを明らかにすることを目標としています。
形は機能の根幹にあります。機能美という言葉は、その機能を果たすために最も適した形を持つものに対して使われます。私たちの体の中も機能美をもつ組織や器官で満たされています。機能する形を作りそれを維持することは生命の基盤であり、形の制御メカニズムを理解することは生命活動や病態を理解するための必須の基礎知識となります。当分野では、特に発生中の動物が発揮する柔軟な環境適応力や修復力を時系列で解析することで、器官の形態の「形成」と「恒常性」を制御する分子プログラムを明らかにします。
動物の器官や組織の形は、それらを構成する細胞が集団となって動き、正しく配列することで作られます。この過程は受精によって起動される一連の遺伝子発現によって制御されており、これまでに、器官や組織を形づくる細胞運動を制御する遺伝子が多く発見されています。形態形成 (Morphogenesis) の制御メカニズムは発生生物学分野の重要な課題の1つとして長らく研究されてきました。
一方で、一旦起動されれば自動的に進んでいるように見える形態形成は、環境に応じてその過程を変化させていると考えられています。例えば水の中で発生する魚類や両生類など卵生動物の胚は、温度やpH、栄養などの水質の変動をダイレクトに受けます。環境ストレスが胚発生に深刻なダメージを与えないように、胚は発生のスピードや体の形を一定の範囲内で変えて対応します。そのような現象には正常な形態形成では見られない柔軟な形態制御メカニズムが潜んでいる可能性があります。
当分野では、両生類モデル動物であるアフリカツメガエル (Xenopus laevis) の胚や幼生 (オタマジャクシ) を使用して、組織・器官の形態制御メカニズムを ①正常な形態形成、②環境ストレスが起動する形態制御、の2つの面から探索します。細胞の可視化や発生中の環境操作が容易なアフリカツメガエル胚から得られる情報を足がかりに、生物全般に保存される器官の形態をコントロールするメカニズムに迫ります。現在は以下の (1) 栄養環境に応じて変化する器官形態制御、(2) 胚組織の形態恒常性と修復、の2つのプロジェクトに取り組んでいます。
(1) 栄養環境に応じて変化する器官形態制御
栄養と器官形成 アフリカツメガエルの幼生は体が完成しない段階から餌を食べ始め、器官形成を継続します。餌が豊富な環境では全身の発生は問題なく継続しますが、興味深いことに、餌がない環境では形態形成が進行しない器官が存在します。正常な形態形成を制御する分子プログラムと低栄養環境のみで活性化する分子プログラムを探索し比較すれば、器官形態の新しい制御メカニズムを発見できる可能性があります。
甲状腺形態形成をモデルとして 両生類の甲状腺はヒトと同じ形態を持ち、発生中の幼生は甲状腺ホルモンを貯蔵するための濾胞構造を徐々に形成します (図・上段)。 研究グループでは、アフリカツメガエル幼生を使った細胞レベルの組織イメージングと発現遺伝子の網羅的な解析により、甲状腺の形態形成が低栄養環境で一時停止する可能性を見出しています (図・下段)。このことは栄養摂取依存的に活性化する何らかの分子が甲状腺濾胞の形態を制御する可能性を示しています。本プロジェクトでは、甲状腺形成を「栄養が豊富な環境」と「低栄養環境」で比較することにより、甲状腺の細胞を動かす役割を担う細胞骨格、細胞接着の制御メカニズムを明らかにします。さらに、栄養が甲状腺形態を制御するメカニズムを代謝やホルモンなどの全身を巡るシステムにまで広げて分子レベルで明らかにします。

研究の展望
全身臓器の観察が容易なアフリカツメガエル幼生を使えば、甲状腺以外にも栄養摂取によって形態が制御される器官が存在するか検証することができます。また、人を含めた哺乳類の胎生期の栄養、つまり母体の栄養状態が胎児の細胞をどう動かしうるのか、哺乳類の実験系では検証が難しい課題をアフリカツメガエル実験系からヒントを得て掘り下げることも可能です。種を超えて保存される共通の分子を手掛かりに、人の先天性の器官形成不全症との関係を検証することも視野に入れて研究を進めます。
(2) 胚組織の形態恒常性維持と修復
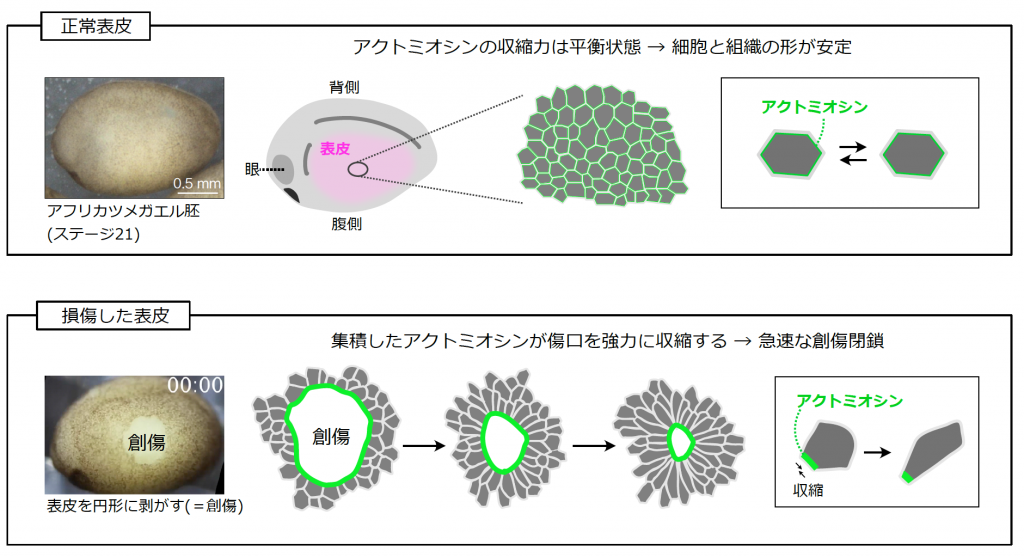
胚組織の形態形成の要:アクトミオシン 細胞骨格アクチンとモーター蛋白質ミオシンの複合体であるアクトミオシン (actomyosin) は形態形成における細胞の駆動力として様々なモデル動物で注目されています。アクトミオシンはミオシンのモーター機能を利用して細胞膜を収縮する力を生み出します。アクトミオシンが生み出す収縮力により、細胞は移動や形の変化が可能となり、組織や器官を形づくることができます。このため、アクトミオシンの制御メカニズムを明らかにすることは組織や器官、体の形の成り立ちを理解する上で必須となります。
組織の形を自在に操るアクトミオシン アフリカツメガエル胚の表皮は安定した形を持ち、細胞が活発に動いたり形を変化させたりすることが比較的少ない組織です (図・上段)。当研究室では、胚表皮の形態恒常性に関連するアクトミオシンの新たな制御分子セットを見出しています。これらの分子の機能を解析すると、正常な表皮ではアクトミオシンが必要のない収縮力を発生させないような制御メカニズムがあり、表皮の形の維持に貢献していることがわかってきました (図・上段)。一方、表皮が損傷を受けると傷口の細胞はアクトミオシンを瞬時に活性化させて強力な収縮力を発生し、3分以内に細胞を動かして創傷修復を開始します。創傷の大きさによってはその後数十分で完全に修復することができます(図・下段)。本プロジェクトでは、「正常表皮」と「異常から回復しようとする表皮」を比較しそれぞれのアクトミオシンの制御メカニズムを明らかにすることで、表皮の形態を制御する分子メカニズムを明らかにします。
研究の展望
アフリカツメガエル胚表皮でアクトミオシンを制御する候補分子の中には、人の別の組織の恒常性維持に使われている分子もあります。胚表皮でアクトミオシンを制御する分子が、人では異なる使われ方、もしくは同様の機能を拡充して使われている可能性もあります。胚表皮のアクトミオシンと創傷修復の制御メカニズムの解明を介して、胚と成体、両生類と哺乳類、これらの壁を超える組織形態の制御システムを明らかにします。
大学院進学を考えている皆さんへ
形態制御分野では大学院生を大募集しています(入試情報・大学院医学教育部)。発生中の組織や器官の形態形成や形態恒常性を維持しようとする細胞のふるまい、発生中の動物のタフな逆境対応力に興味がある方、さらには基礎生物学的研究から人の生物学(医学)にも通じる形態制御メカニズムを発見したい方、一緒に進藤と仕事をしませんか?上の2つのプロジェクトでは、共焦点顕微鏡を使ったイメージングや遺伝子ノックアウトなど、最新の手法を取り入れた実験ができます。自由な発想で実験を繰り返して生命の原理に近づく楽しさを味わうと自分の世界も広がっていきます。国外の研究者とも積極的に交流しています。出身学部や経験は問いません。ご興味のある方はshindo(at)kumamoto-u.ac.jpまでご連絡ください ((at)を@に変えて送信ください)。実験を体験したい学部生の方もお気軽にどうぞ。